题目内容
20.已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:(1)该反应中,化合价升高的反应物是KCl,化合价没有发生变化的反应物是H2SO4.
(2)写出一个包含上述七种物质的氧化还原反应方程式(不需配平)KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O.
(3)上述反应中,氧化剂是KMnO4,1mol氧化剂在反应中得到(填“得到”或“失去”)5mol电子.
分析 将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则发生HCl与KMnO4的氧化还原反应;则七种物质发生KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则发生HCl与KMnO4的氧化还原反应,则七种物质发生KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O,
(1)Cl元素的化合价升高,则KCl为还原剂,化合价没有发生变化的反应物是H2SO4,故答案为:KCl;H2SO4;
(2)由信息可知,高锰酸钾能氧化氯离子,则发生的氧化还原反应为KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O,
故答案为:KCl+KMnO4+H2SO4→MnSO4+K2SO4+Cl2+H2O;
(3)Mn元素的化合价降低,KMnO4为氧化剂,1mol氧化剂得到1mol×(7-2)=5mol电子,故答案为:KMnO4;得到;5.
点评 本题考查氧化还原反应,为高频考点,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及知识迁移应用能力的考查,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
11.两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的( )
| A. | Mg、Ag | B. | Fe、Mg | C. | Al、Zn | D. | Mg、Al |
8.下列有关叙述正确的是( )
| A. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 | |
| B. | PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 | |
| C. | 田间焚烧秸秆易造成灰霾,灰霾粒子平均直径在1000~2000nm之间,能发生丁达尔效应 | |
| D. | 汽车尾气净化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 |
15.下列四位同学设计的实验方案能达到实验目的是( )
| A. | 甲同学为测定0.01mol•L-1盐酸的pH值:用湿的玻璃棒蘸取盐酸,点在pH试纸上 | |
| B. | 乙同学要检验(NH4)2Fe(SO4)2•12H2O晶体中的NH4+:取少量晶体溶于水,加入足量浓NaOH溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| C. | 丙同学为检验Fe3O4中+2价铁元素:先用稀盐酸溶解Fe3O4,再滴加KMnO4溶液 | |
| D. | 丁同学要验证FeCl3与KI反应的限度:可将少量的FeCl3溶液与过量的KI溶液混合,充分反应后用CCl4萃取,静置,再滴加KSCN溶液 |
12.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)═MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
9.下列物质中属于碱性氧化物的是( )
| A. | CO2 | B. | CuO | C. | H2O | D. | Ca(OH)2 |
 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题: .
.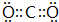 .
.