题目内容
10.已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A、C原子的L能层中都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:(1)基态E原子中,电子占据的最高能层符号为N,该能层具有的原子轨道数为16.
(2)E3+离子的价层电子排布式为3d5.
(3)DCl2中D原子采取的轨道杂化方式为sp3,C元素的气态氢化物的VSEPR模型名称为四面体.
(4)写出一个与DAB-离子互为等电子体的合理分子式:
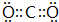 .
.(5)已知F的晶体结构为面心立方,F的原子直径d=0.256nm,求1cm3 F中,含有F原子的个数约为8.44×1022个.(保留3位有效数字).
分析 A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素,据此解答.
解答 解:A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素,
(1)E为Fe,原子核外电子排布为1s22s22p63s23p63d64s2,电子占据的最高能层为第4能层,符号N,该能层有1个s轨道、3个p轨道、5个d轨道、7个f轨道,共有16 个原子轨道,故答案为:N;16;
(2)Fe3+离子的价层电子排布式为3d5,故答案为:3d5;
(3)SCl2中S原子价层电子对数为2+$\frac{6-1×2}{2}$=4,S原子采取sp3杂化方式,C的气态氢化物为H2O,2+$\frac{6-1×2}{2}$=4,VSEPR模型名称为四面体,故答案为:sp3;四面体;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,CO2的电子式为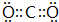 ,故答案为:
,故答案为: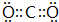 ;
;
(5)Cu的晶体结构为面心立方,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu原子直径d=0.256nm,则晶胞体积为($\sqrt{2}$×2.56×10-8cm)3,则1cm3 Cu中含有Cu原子数目为:[1cm3÷($\sqrt{2}$×2.56×10-8cm)3]×4=8.44×1022,
故答案为:8.44×1022.
点评 本题是对考查物质结构的考查,涉及核外电子排布、杂化理论、等电子体、配合物、晶胞计算等,需要学生具备扎实的基础,(5)中计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 钢是用量最大的合金 | |
| B. | 铝锂合金抗腐蚀能力很强,可耐酸碱腐蚀 | |
| C. | 我国在商代就开始使用铜合金 | |
| D. | 铝合金的强度、硬度比纯铝大 |
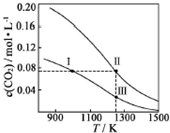 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 化学平衡常数K:K(状态Ⅰ)<K(状态Ⅱ)<K(状态Ⅲ) | |
| B. | CO2的平衡转化率α:α(状态Ⅰ)<α(状态Ⅱ)=α(状态Ⅲ) | |
| C. | 体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
| A. | 偏铝酸钡 Ba(AlO2)2 | B. | 明矾 KAl(SO4)2•12H2O | ||
| C. | 醋酸钙 (CH3COO)2Ca | D. | 亚硫酸氢钙 CaHSO3 |
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
| A. | 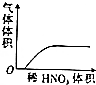 稀HNO3滴入Na2SO3溶液中 | B. | 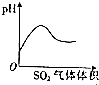 SO2气体通入新制氯水中 | ||
| C. | 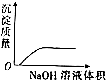 NaOH溶液滴入Ba(HCO3)2溶液中 | D. | 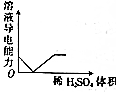 稀H2SO4滴入Ba(OH)2溶液中 |
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下: