题目内容
11.使用196克纯硫酸加水配制成200ml溶液,则此溶液中氢离子的物质的量浓度为多少?分析 根据c=$\frac{n}{V}$计算硫酸浓度,氢离子的物质的量浓度是硫酸浓度的2倍来解答.
解答 解:硫酸浓度c=$\frac{\frac{196g}{98g/mol}}{0.2L}$=10mol/L,氢离子的物质的量浓度10mol/L×2=20mol/L;
答:此溶液中氢离子的物质的量浓度为20mol/L.
点评 本题考查物质的量浓度的计算,侧重于学生的分析、计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
2.在8.08g铁与铜的混和物中,加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属5.44g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属4.48g.若硝酸的还原产物只有NO,下列说法正确的是( )
| A. | 剩余的5.44g金属为铁 | B. | 剩余5.44g金属为铜 | ||
| C. | 共生成NO气体 0.03mol | D. | 8.08g金属中铁的质量分数为20.8% |
19.实验室电解饱和食盐水( )
| A. | 阳极发生还原反应 | B. | 铁丝接电源的负极 | ||
| C. | 电子由阴极经溶液流向阳极 | D. | 氯气在阴极区产生 |
6.在明矾溶液中逐滴加入Ba(OH)2溶液,不可能发生的反应的离子方程式是( )
| A. | Al3++SO42-+Ba2++3OH-→BaSO4↓+Al(OH)3↓ | |
| B. | Al3++2SO42-+2Ba2++4OH-→BaSO4↓+AlO2- | |
| C. | 2 Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ | |
| D. | 4Al3++7SO42-+7Ba2++14OH-→7BaSO4↓+2Al(OH)3↓+2AlO2- |
8.下列叙述正确的是( )
| A. | 氧化性:F2<Cl2<Br2<I2 | |
| B. | 次氯酸能杀死病菌,所以氯气可用于自来水的消毒 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
9.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A. | ②③④ | B. | ①③④ | C. | ①②③④ | D. | ①②③④⑤ |
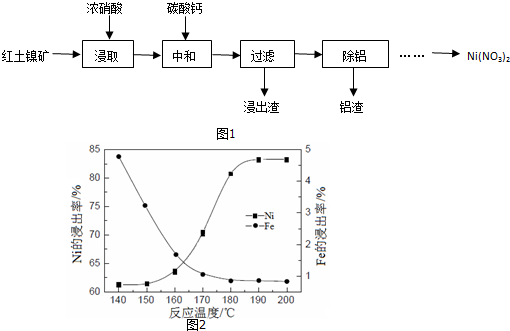
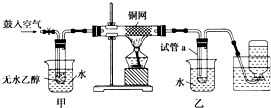 某实验小组用下列装置进行乙醇催化氧化的实验.
某实验小组用下列装置进行乙醇催化氧化的实验.