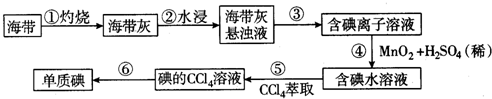
题目内容
9.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )| A. | 原子半径:Y>Z>X>W | |
| B. | 气态氢化物的热稳定性:Y<Z | |
| C. | 简单阴离子的还原性:Y>X | |
| D. | 最高价氧化物对应的水化物的酸性:Z>Y |
分析 W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子的半径大小为:Y>Z>W>X,故A错误;
B.Y为S、Z为Cl元素,非金属性Cl>S,则气态氢化物的稳定性:H2S<HCl,即Y<Z,故B错误;
C.非金属性O<S,则阴离子的还原性S2->O2-,故C正确;
D.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则最高价含氧酸的酸性:Z>Y,故D正确;
故选A.
点评 本题考查原子结构和元素周期律的综合应用,为高频考点和常见题型,题目难度中等,侧重考查学生分析、推断能力,明确元素周期律内涵即可解答,注意掌握非金属性、金属性强弱判断方法.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
20.实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的是( )
| A. | 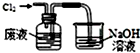 氧化废液中的溴化氢 | B. | 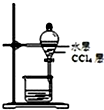 分离CCl4层和水层 | ||
| C. |  分离CCl4和液溴 | D. | 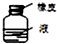 长期贮存液溴 |
17.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | NA个Al(OH)3胶体粒子的质量为78g | |
| B. | 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 标准状况下,2.24 L己烷中共价键数目为1.9NA |
4. 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
(1)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形.
(2)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.MgO晶体的熔点高于NaCl晶体主要原因是MgO晶体中所含离子半径小、电荷数多,晶格能大.其中基态C1-的核外电子排布式为:1s22s22p63s23p6.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式.如果相同,则其杂化方式为sp3杂化;如果不相同,则其杂化方式分别为不填.写出CCl4的一种等电子体的化学式:SO42-等.
(5)CuCl42-是黄色的,而CuCl2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子.
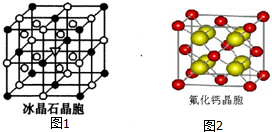
(6)在电解冶炼铝的过程中加入冰晶石(Na3AlF6),可起到降低A12O3熔点的作用.冰晶石由两种微粒构成,冰晶石的晶胞结构如图1甲所示,●位于大立方体的顶点和面心,O位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
(7)已知CaF2晶体(如图2),其中Ca2+的配位数为8.CaF2晶体的密度为ρg•cm-3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:(1)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形.
(2)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.MgO晶体的熔点高于NaCl晶体主要原因是MgO晶体中所含离子半径小、电荷数多,晶格能大.其中基态C1-的核外电子排布式为:1s22s22p63s23p6.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
(5)CuCl42-是黄色的,而CuCl2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子.
(6)在电解冶炼铝的过程中加入冰晶石(Na3AlF6),可起到降低A12O3熔点的作用.冰晶石由两种微粒构成,冰晶石的晶胞结构如图1甲所示,●位于大立方体的顶点和面心,O位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
(7)已知CaF2晶体(如图2),其中Ca2+的配位数为8.CaF2晶体的密度为ρg•cm-3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
14.继屠呦呦从青蒿中成功提取出青蒿素后,中国科学院上海有机化学研究所又在1982年人工合成了青蒿素,其部分合成路线如图所示:下列说法不正确的是( )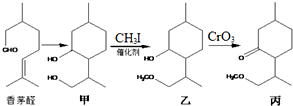

| A. | 香茅醛能发生加聚反应和缩聚反应 | |
| B. | “甲→乙”发生了取代反应 | |
| C. | 甲中不同化学环境的羟基化学性质不同 | |
| D. | 香茅醛存在顺反异构现象 |
1.在10L恒容密闭容器中充入X(g)和Y(g).发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
下列说法正确的是( )
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| A. | 实验①中,若5min时测得n(M)=0.050mol,则0~5min时间内,用N表示的平均反应速率v(N)=l.0×10-2 mo1•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 该反应的正反应方向为吸热反应 |
16.药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
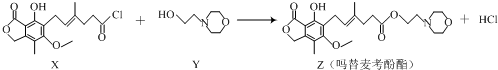
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
 .
. .
.