题目内容
20.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:-2221.5kJ/mol,下列有关说法正确的是( )| A. | 奥运火炬燃烧主要是将化学能转变为热能和光能 | |
| B. | 丙烷常温下是液体 | |
| C. | 丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极 | |
| D. | 丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol |
分析 A.燃料燃烧过程中放出热量且同时产生光;
B.碳原子个数小于等于4的烷烃常温下都是气态;
C.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极;
D.水蒸气不是氢元素的稳定氧化物.
解答 解:A.燃料燃烧过程中放出热量且同时产生光,所以奥运火炬燃烧主要是将化学能转变为热能和光能,故A正确;
B.碳原子个数小于等于4的烷烃常温下都是气态,丙烷分子中含有3个C原子,所以常温下丙烷是气体,故B错误;
C.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,则丙烷、空气和铂片构成的原电池中,通入丙烷的电极是负极,故C错误;
D.水蒸气不是氢元素的稳定氧化物,丙烷的燃烧热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ/mol,故D错误;
故选A.
点评 本题考查化学电源新型电池、热化学方程式等知识点,为高频考点,明确原电池原理、热化学方程式书写方法是解本题关键,注意燃烧热概念中关键词,题目难度不大.

练习册系列答案
相关题目
15.下列几种气体中,在同温同压下,等质量时所占体积最大的是( )
| A. | 一氧化碳 | B. | 氯化氢 | C. | 、二氧化碳 | D. | 氖气 |
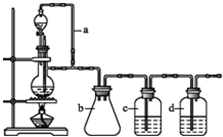
5.工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置.实验时按如下步骤操作:
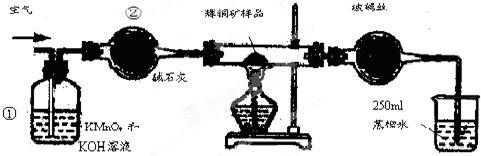
实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低(写一种即可).
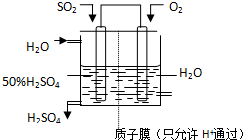
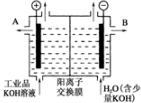
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数.
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中的还原性气体与酸性气体;装置②的作用是干燥空气.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是80%.
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.

12.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1mol•L-1Na2S溶液中含有0.2NA个Na+ | |
| B. | 标准状况下,22.4L的H2O含有2NA个氢原子 | |
| C. | 常温下,44gCO2含有NA个氧原子 | |
| D. | 0.1molNa与足量O2反应生成Na2O,转移0.1NA个电子 |
10.下列叙述正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质中一定存在共价键 | |
| C. | 共价化合物中一定存在共价键 | |
| D. | 离子化合物中只含有离子键 |
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.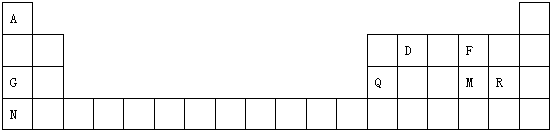
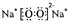 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 .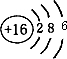 .
.