题目内容
下列物质的性质、用途正确的是( )
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、Na2SiO3是制备硅胶和木材防火剂的原料 |
| C、食盐可作调味剂,不可作防腐剂 |
| D、合金的硬度大,熔点也高 |
考点:浓硫酸的性质,硝酸的化学性质,含硅矿物及材料的应用,金属与合金在性能上的主要差异,常见的食品添加剂的组成、性质和作用
专题:元素及其化合物
分析:A.常温下,浓硫酸和浓硝酸与Al、Fe都发生钝化现象;
B.硅酸钠不燃烧也不支持燃烧,硅酸钠和稀盐酸反应生成硅酸;
C.食盐可以作防腐剂;
D.合金的硬度大、熔点低.
B.硅酸钠不燃烧也不支持燃烧,硅酸钠和稀盐酸反应生成硅酸;
C.食盐可以作防腐剂;
D.合金的硬度大、熔点低.
解答:
解:A.常温下,浓硫酸和浓硝酸与Al、Fe都发生钝化现象而阻止进一步反应,所以常温下,浓硫酸和浓硝酸可以用Fe或Al容器盛放,故A错误;
B.硅酸钠不燃烧也不支持燃烧,硅酸钠和稀盐酸反应生成难溶性的硅酸而制得硅胶,所以Na2SiO3是制备硅胶和木材防火剂的原料,故B正确;
C.食盐它可以使细菌细胞脱水死亡,所以可以杀菌,可作为防腐剂,食盐具有咸味是咸味剂,故C错误;
D.合金的硬度比其成分都大、熔点比其成分都低,故D错误;
故选B.
B.硅酸钠不燃烧也不支持燃烧,硅酸钠和稀盐酸反应生成难溶性的硅酸而制得硅胶,所以Na2SiO3是制备硅胶和木材防火剂的原料,故B正确;
C.食盐它可以使细菌细胞脱水死亡,所以可以杀菌,可作为防腐剂,食盐具有咸味是咸味剂,故C错误;
D.合金的硬度比其成分都大、熔点比其成分都低,故D错误;
故选B.
点评:本题考查物质的用途,明确物质的性质是解本题关键,知道其使用原理,注意:钝化现象不是不反应,为易错点.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
用惰性电极电解下列各组物质的溶液时,发生的电极反应完全相同的是( )
| A、NaOH、H2SO4、Na2SO4 |
| B、CuSO4、CuCl2、H2SO4 |
| C、NaOH、HCl、NaCl |
| D、KCl、NaCl、Na2SO4 |
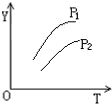 对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )
对于密闭容器中的可逆反应:4L(g)?2M(g)+N(g)△H>0,其平衡状态与温度(T)和压强(P1>P2)的关系如图所示.图中y轴是指( )| A、气体混合物的平均相对分子质量 |
| B、气体混合物的总物质的量浓度 |
| C、L在气体混合物的体积分数 |
| D、气体混合物的密度 |
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )| A、若甲为单质铁,则丙一定为FeCl3 |
| B、若甲为强碱,则X一定为CO2 |
| C、若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+ |
| D、若甲为单质,则此关系中涉及的反应一定都是氧化还原反应 |
下列有关电解质溶液中粒子的物质的量浓度关系正确的是( )
| A、在0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO4-)+2c(H2CO3) |
| C、向0.2mol?L-1NaHCO3溶液中加入等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,pH=7的CH3COONa和CH3COOH混合溶液:c(Na+)+c(CH3COO-)═c(H+)+c(OH-) |
下列有关糖类、油脂、蛋白质的说法正确的是( )
| A、向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,有白色沉淀产生,说明蛋白质发生了变性 |
| B、棉花、纸、醋酸纤维的主要成分都是纤维素 |
| C、淀粉、牛油、蛋白质都是天然高分子化合物 |
| D、油脂里饱和烃基的相对含量越大,油脂的熔点越高 |
下列依据相关数据作出的推理和判断中,不正确的是( )
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C、依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
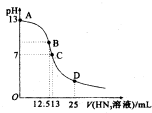 氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题:
氮气是空气中含量最多的一种气体,氮气及其化合物在工农业生产、生活中有着广泛的应用.请回答下列问题: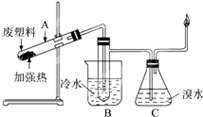 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如下表
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如下表