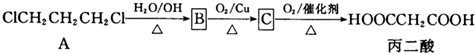
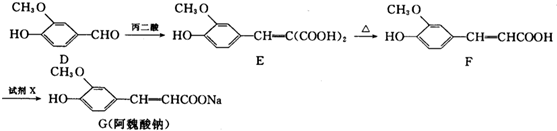
题目内容
下列文字表述与反应的离子方程式对应且正确的是( )
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | ||
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | ||
| C、苯酚与纯碱溶液混合:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | ||
D、甲醛溶液与足量的银氨溶液共热HCHO+4Ag(NH3)2++4OH-
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.溴乙烷中没有自由移动的溴离子,所以溴乙烷和硝酸银溶液不反应;
B.弱电解质醋酸应该写化学式;
C.二者反应生成碳酸氢钠和苯酚钠;
D.二者反应生成二氧化碳、银、氨气和水.
B.弱电解质醋酸应该写化学式;
C.二者反应生成碳酸氢钠和苯酚钠;
D.二者反应生成二氧化碳、银、氨气和水.
解答:
解:A.溴乙烷中没有自由移动的溴离子,所以溴乙烷和硝酸银溶液不反应,则没有离子方程式为,故A错误;
B.弱电解质醋酸应该写化学式,离子方程式为CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.二者反应生成碳酸氢钠和苯酚钠,离子方程式为C6H5OH+CO32-→HCO3-+C6H5O-,故C错误;
D.二者反应生成碳酸根离子、银、氨气和水,离子方程式为HCHO+4Ag(NH3)2++4OH-
CO32-+2NH4++4Ag↓+6NH3+2H2O,故D正确;
故选D.
B.弱电解质醋酸应该写化学式,离子方程式为CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.二者反应生成碳酸氢钠和苯酚钠,离子方程式为C6H5OH+CO32-→HCO3-+C6H5O-,故C错误;
D.二者反应生成碳酸根离子、银、氨气和水,离子方程式为HCHO+4Ag(NH3)2++4OH-
| △ |
故选D.
点评:本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则即可解答,注意溴乙烷中溴元素的检验方法,注意C中碳酸氢根离子酸性小于苯酚,这些都是易错点.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、植物油可与氢气发生加成反应转变为脂肪 |
B、含1 mol 该羟基酸的溶液可与含3 mol氢氧化钠的溶液恰好完全反应 该羟基酸的溶液可与含3 mol氢氧化钠的溶液恰好完全反应 |
| C、CH3-CO18OH和CH3CH2-OH发生酯化反应得到的乙酸乙酯的相对分子质量为90 |
| D、油脂、聚乙烯、淀粉、纤维素、蛋白质都是混合物 |
 如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )
如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )| A、甲烷燃烧为吸热反应 |
| B、甲烷的燃烧热△H=-802kJ?mol-1 |
| C、EA-EB=1015kJ |
| D、该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1 |
标准状况是指( )
| A、20℃ |
| B、20℃、101KPa |
| C、0℃、101KPa |
| D、25℃、101KPa |
已知常温下Ksp[Mg(OH)2]=3.2×10-11、Ksp[Fe(OH)3]=2.7×10-39,下列说法正确的是( )
| A、将10g氢氧化铁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化铁溶液,c(OH-)=3×10-10mol/L |
| B、将10g氢氧化镁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化镁溶液,加入酚酞试液后不能变红 |
| C、若1mol/L氯化镁溶液中混有氯化铁,调节pH=9,可以保证镁离子不沉淀而铁离子沉淀完全 |
| D、根据溶度积数据,可以计算出氢氧化铁固体与盐酸反应:Fe(OH)3+3H+?Fe3++3H2O的平衡常数为2.7×103 |
下列有机物中,属于芳香烃的是( )
A、 |
B、 |
C、 |
D、 |