题目内容
15.物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )| A. | 2:3 | B. | 1:5 | C. | 1:4 | D. | 2:5 |
分析 锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.
解答 解:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O.故选C.
点评 本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应中的运用.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
6.符合分子式C4H9Cl的同分异构体的数目为( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
3.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )
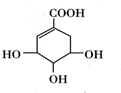

| A. | 分子式为C7H10O5 | |
| B. | 1mol该有机物与足量的钠发生反应,最多消耗3molNa | |
| C. | 该有机物既可与乙醇发生酯化反应,也可与乙酸发生酯化反应 | |
| D. | 该有机物可使KMnO4溶液褪色 |
10.下列指定反应的离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 用白醋、淀粉碘化钾试纸检验加碘盐是否含碘:5I-+IO3-+6H+=3I2+3H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 用洁厕剂(主要成分HCl)与大理石反应:CaCO3+2H+=Ca2++CO2↑+H2O |
20.如图,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )


| A. | 锌片是原电池负极 | B. | 铜片质量逐渐减少 | ||
| C. | H+在负极得到电子被还原 | D. | 电流从锌片经导线流向铜片 |
7.现有三种有机物甲、乙、丙,其结构如图所示:

下列有关说法中正确的是( )

下列有关说法中正确的是( )
| A. | 均能与碳酸氢钠反应 | |
| B. | 只用碳酸钠溶液和银氨溶液能检验甲、乙、丙 | |
| C. | 与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3:4:3 | |
| D. | 甲的化学式为C11H13O2,乙含有两种含氧官能团 |
4.把铁片投入下列溶液中,铁片质量减小,且没有气体产生,此溶液是( )
| A. | FeSO4 | B. | H2SO4 | C. | Fe2(SO4)3 | D. | AgNO3 |
5.下列关于Na+的叙述错误的是( )
| A. | 在空气中很稳定 | B. | 焰色反应显黄色 | ||
| C. | 与水反应放出氢气 | D. | 半径比钠原子小 |