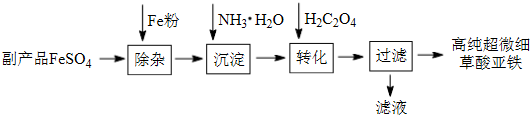
题目内容
已知:H2(g)+
O2(g)=H2O(g)△H=-242kJ/mol,断开1 mol O=O键和1 molH-O键所吸收的能量分别为496 kJ和463kJ,则断开1 mol H-H键所吸收的能量为( )
| 1 |
| 2 |
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
考点:有关反应热的计算,反应热和焓变
专题:化学反应中的能量变化
分析:旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,断开1 mol O=O键和1 molH-O键所吸收的能量分别为496 kJ和463kJ,H2(g)+
O2(g)=H2O(g)△H=-242kJ/mol,依据△H=反应物的总键能-生成物的总键能进行计算.
| 1 |
| 2 |
解答:
解:1 molH2O中含2molH-O键,断开1 mol O=O键和1 molH-O键所吸收的能量分别为496 kJ和463kJ,令H-H键的键能为x,
对于反应H2(g)+
O2(g)=H2O(g)△H=-242kJ/mol,反应热=反应物的总键能-生成物的总键能,故△H=xkJ/mol+
×496kJ/mol-2×463kJ/mol=-242kJ/mol
解得:x=436 kJ/mol
故选C.
对于反应H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
解得:x=436 kJ/mol
故选C.
点评:本题考查反应热的有关计算,掌握反应热与键能的关系是解答关键,题目难度不大.

练习册系列答案
相关题目
在某温度下,反应S2Cl2(l)+Cl2(g)?2SCl2(l);△H=-5016kJ/mol,在密闭容器中达到平衡,下列说法错误的是( )
橙黄色 鲜红色.
橙黄色 鲜红色.
| A、温度不变,增大容器的体积,液体的颜色变浅 |
| B、温度不变,减少容器的体积,S2Cl2的转化率降低 |
| C、压强不变,升高温度,液体的颜色变浅 |
| D、体积不变,降低温度,氯气的转化率升高 |
室温时,将浓度和体积分别为c1、V1的盐酸溶液和c2、V2的氨水溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
下列叙述正确的是( )
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、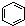 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、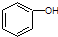 和 和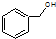 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
以下属于共价分子的单质是( )
| A、氩气 | B、金刚石 | C、重氢气 | D、水 |