题目内容
5.W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素.Y和W的最外层电子数相等.Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍.由此可知:(1)写出元素名称:W氢,X氧,Y钠,Z在元素周期表中的位置第三周期ⅥA族.
(2)Y2Z的电子式为
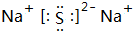 ;W2X2的结构式H-O-O-H.
;W2X2的结构式H-O-O-H.(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O.
分析 W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,只有Y为金属元素,由于短周期的金属只有Li、Be、Na、Mg、Al,则Y只能为第三周期元素,则Z也是第三周期元素,X为第二周期元素,Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍,而Y、Z原子序数之和至少为11+14=25,最大为13+17=30,且能被3整除,只能为27或30,则W、X原子序数之和为9或10,Y和W的最外层电子数相等,二者同主族,若Y、W处于ⅢA族,则W为B元素、Y为Al,X是原子序数为3或5,不符合题意,则Y和W处于IA族,故W为H元素、Y为Na,Y与Z的原子序数之和只能为27,故Z的原子序数为16,则Z为S元素,X的原子序数为9-1=8,则X为O元素,据此解答.
解答 解:W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,只有Y为金属元素,由于短周期的金属只有Li、Be、Na、Mg、Al,则Y只能为第三周期元素,则Z也是第三周期元素,X为第二周期元素,Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍,而Y、Z原子序数之和至少为11+14=25,最大为13+17=30,且能被3整除,只能为27或30,则W、X原子序数之和为9或10,Y和W的最外层电子数相等,二者同主族,若Y、W处于ⅢA族,则W为B元素、Y为Al,X是原子序数为3或5,不符合题意,则Y和W处于IA族,故W为H元素、Y为Na,Y与Z的原子序数之和只能为27,故Z的原子序数为16,则Z为S元素,X的原子序数为9-1=8,则X为O元素.
(1)由上述分析可知,W为氢,X为氧,Y为钠,Z为S,硫在元素周期表中的位置:第三周期ⅥA族,
故答案为:氢;氧;钠;第三周期ⅥA族;
(2)Na2S的电子式为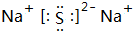 ;H2O2的结构式为H-O-O-H,
;H2O2的结构式为H-O-O-H,
故答案为: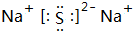 ;H-O-O-H;
;H-O-O-H;
(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是:NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O,
故答案为:NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生的分析推理能力,熟练掌握短周期元素.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案提示:①H2C2O4是二元弱酸
②10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4═8MnSO4+9K2SO4+40CO2↑+32H2O.
| A. | 0.0800 | B. | 0.1200 | C. | 0.1600 | D. | 0.2400 |
| A. | Fe溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| D. | 铝与浓氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| A. | 镁粉与稀醋酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+OH-═Cl-+ClO-+H2O |
| A. | 胶体一定是混合物 | |
| B. | 丁达尔效应可用于鉴别胶体和溶液 | |
| C. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于净化自来水 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小可吸入颗粒物,其与空气形成的分散系属于胶体 |
已知:①C7H8(l)(NBD)+9O2(g)═7CO2(g)+4H2O(g);△H1;
②C7H8(l)(Q)+9O2(g)═7CO2(g)+4H2O(l);△H2;
③
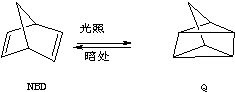 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1下列叙述不正确的是( )
| A. | △H1>△H2 | B. | 等质量NBD的能量比Q的能量高 | ||
| C. | NBD比Q稳定 | D. | NBD转化为Q是吸热反应 |
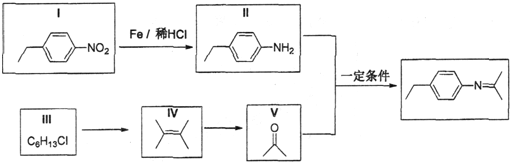

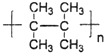
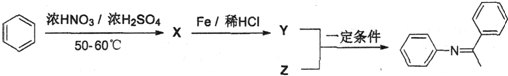
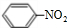 ,Z的结构简式为
,Z的结构简式为
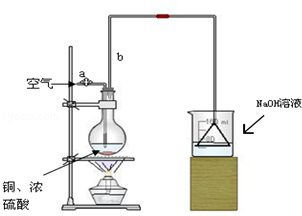 某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.