题目内容
短周期元素A、B、C、D、E原子序数依次增大.已知A原子中无中子,B可以和A形成共价化合物A2B或A2B2,C是短周期中(除稀有气体外)原子半径最大的,D的最外层电子数是最内层电子数的1.5倍,E的最高和最低化合价代数和为6.回答下列有关问题:
(1)A元素为 ,D元素为 (填名称)
(2)E元素在周期表中的位置
(3)A2B的结构式为 ,CE的电子式为
(4)B、C和D的原子半径由大到小的顺序为 (填元素符号)
(5)C的单质和A2B发生反应的化学方程式为
(6)M是由A、B、C形成的化合物,其晶体类型为 ,粒子间作用力为 .
(7)由于条件不同B和C的单质可化合生成两种物质,化学式分别为 和 .
(8)常温时,1gA的单质完全燃烧放出143kJ的热量,写出此温度下的A完全燃烧的热化学方程式 .
(1)A元素为
(2)E元素在周期表中的位置
(3)A2B的结构式为
(4)B、C和D的原子半径由大到小的顺序为
(5)C的单质和A2B发生反应的化学方程式为
(6)M是由A、B、C形成的化合物,其晶体类型为
(7)由于条件不同B和C的单质可化合生成两种物质,化学式分别为
(8)常温时,1gA的单质完全燃烧放出143kJ的热量,写出此温度下的A完全燃烧的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D、E原子序数依次增大.A原子中无中子,则A为H元素;B可以和A形成共价化合物A2B或A2B2,则B为O元素;C是短周期中(除稀有气体外)原子半径最大的,则C为Na元素;D的最外层电子数是最内层电子数的1.5倍,原子序数大于Na,处于第三周期,故最外层电子式为3,则D为Al;E的最高和最低化合价代数和为6,最外层电子数为7,故E为Cl,据此解答.
解答:
解:短周期元素A、B、C、D、E原子序数依次增大.A原子中无中子,则A为H元素;B可以和A形成共价化合物A2B或A2B2,则B为O元素;C是短周期中(除稀有气体外)原子半径最大的,则C为Na元素;D的最外层电子数是最内层电子数的1.5倍,原子序数大于Na,处于第三周期,故最外层电子式为3,则D为Al;E的最高和最低化合价代数和为6,最外层电子数为7,故E为Cl,
(1)由上述分析可知,A为氢元素,D为铝元素,故答案为:氢;铝;
(2)E为Cl元素,在周期表中的位置是:第三周期ⅦA族,故答案为:第三周期ⅦA族;
(3)A2B为H2O,其结构式为H-O-H,CE为NaCl,其电子式为 ,故答案为:H-O-H;
,故答案为:H-O-H; ;
;
(4)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O,故答案为:Na>Al>O;
(5)Na与水反应生成氢氧化钠与氢气,反应化学方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(6)由H、O、Na形成的化合物M为NaOH,其晶体类型为离子晶体,粒子间作用力为离子键、共价键,故答案为:离子晶体;离子键、共价键;
(7)由于条件不同,Na和氧气可化合生成两种物质,化学式分别为Na2O和Na2O2,故答案为:Na2O、Na2O2;
(8)常温时,1g氢气完全燃烧放出143kJ的热量,则2mol氢气完全燃烧放出的热量=143kJ×
=572kJ,此温度下的氢气完全燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol,故答案为:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol.
(1)由上述分析可知,A为氢元素,D为铝元素,故答案为:氢;铝;
(2)E为Cl元素,在周期表中的位置是:第三周期ⅦA族,故答案为:第三周期ⅦA族;
(3)A2B为H2O,其结构式为H-O-H,CE为NaCl,其电子式为
 ,故答案为:H-O-H;
,故答案为:H-O-H; ;
;(4)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O,故答案为:Na>Al>O;
(5)Na与水反应生成氢氧化钠与氢气,反应化学方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(6)由H、O、Na形成的化合物M为NaOH,其晶体类型为离子晶体,粒子间作用力为离子键、共价键,故答案为:离子晶体;离子键、共价键;
(7)由于条件不同,Na和氧气可化合生成两种物质,化学式分别为Na2O和Na2O2,故答案为:Na2O、Na2O2;
(8)常温时,1g氢气完全燃烧放出143kJ的热量,则2mol氢气完全燃烧放出的热量=143kJ×
| 2mol×2g/mol |
| 1g |
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固,注意掌握电子式、微粒半径比较、热化学方程式书写.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
下列化学用语的表达,正确的是( )
| A、氮气的电子式:N??N |
| B、乙烯的结构简式:CH2CH2 |
| C、二氧化碳分子的结构式:O-C-O |
D、CH4分子的球棍模型: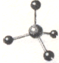 |

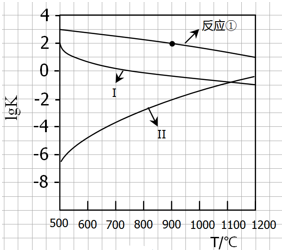 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.