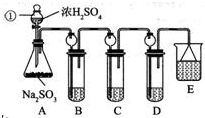
题目内容
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,2 mol SO3含有的氧原子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32-)=1 mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的浓度为1 mol/L |
分析 A、三氧化硫中含3个氧原子;
B、铁粉的物质的量不明确;
C、碳酸根为弱酸根,在溶液中会水解;
D、将过氧化钠溶于1L水中,溶液体积大于1L.
解答 解:A、三氧化硫中含3个氧原子,故2mol三氧化硫中含6mol氧原子即6NA个,故A正确;
B、铁粉的物质的量不明确,故铁粉和浓硫酸反应后转移的电子数无法确定,故B错误;
C、碳酸根为弱酸根,在溶液中会水解,故当c(CO32-)=1 mol/L,钠离子浓度大于2mol/L,则钠离子的个数大于2NA个,故C错误;
D、将过氧化钠溶于1L水中,溶液体积大于1L,故溶液中的钠离子的浓度小于1mol/L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
18.肉桂酸甲酯(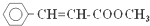 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
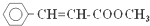 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )| A. | 能与溴的四氯化碳溶液发生加成反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 在碱性条件下能发生水解反应 | |
| D. | 不可能发生加聚反应 |
15. 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
( )
 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X | 酸性高锰酸钾溶液 | 溶液褪色 | X一定SO2 |
| B | NH3 | 酚酞试液 | 溶液变为红色 | 氨水呈碱性 |
| C | NO2 | KI-淀粉溶液 | 溶液变为蓝色 | NO2有还原性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
2.下列除杂质的方法不可行的是( )
| A. | 除去CO2中混有的少量CO,通入适量氧气后点燃 | |
| B. | 将混合气体通过灼热的铜网除去N2中的少量氧气 | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | 用盐酸除去AgCl中少量的Ag2CO3 |
12.能正确表示下列反应的离子方程式是( )
| A. | NH4HCO3溶液中加入足量NaOH溶液共热:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | 用食醋溶解水垢:CaCO3+2H+═Ca2++CO2↑+H2O Mg(OH)2+2H+═Mg2++2H2O |
19.已知:强酸和强碱在稀溶液中发生反应时的中和热为57.3kJ•mol-1,101k Pa时辛烷的燃烧热为5518kJ•mol-1.则下列热化学方程式书写正确的是( )
| A. | H++OH-═H2O△H=-57.3kJ•mol-1 | |
| B. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1 | |
| C. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=-11036kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-5518kJ•mol-1 |
16.下列关于氧化钠和过氧化钠的叙述中,正确的是( )
| A. | 都属于碱性氧化物 | B. | 溶于水后所得溶液的成分相同 | ||
| C. | 阴、阳离子个数比不同 | D. | 氧元素的化合价相同 |
17.为提纯下列物质(括号内为少量杂质),所选试剂及操作都正确的是( )
| 选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
| A | NH3(H2O) | 浓硫酸 | 洗气 |
| B | 乙醇(H2O) | 生石灰 | 分液 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 苯(苯酚) | 溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |