题目内容
元素X和Y属于同一主族.负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%.
(1)Y元素在周期表中的位置
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式 ;该分子中中心原子以sp2杂化,是 分子(填极性或者非极性),VSEPR模型为 .
(3)写出X的质量分数为60%的化合物的化学式 ;该分子中中心原子以sp2杂化,是 分子(填极性或者非极性),分子构型 .
(4)由元素氢、X、Y三种元素形成的化合物常见的有两种,其水溶液均呈酸性,试分别写出其化学式 、 ,并比较酸性强弱: .
(1)Y元素在周期表中的位置
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式
(3)写出X的质量分数为60%的化合物的化学式
(4)由元素氢、X、Y三种元素形成的化合物常见的有两种,其水溶液均呈酸性,试分别写出其化学式
考点:原子结构与元素的性质,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:负二价的元素X和氢的化合物在通常情况下是一种液体,其中X的质量分数为88.9%,负二价的元素X和氢的化合物为H2X,令X的相对分子质量为a,则
=88.9%,解得a=16,所以X为氧元素;
元素X和Y属于同一主族,处于ⅥA族,元素X和元素Y可以形成两种化合物为YO2和YO3,YO2和YO3中O的质量分数分别为50%和60%,令Y的相对原子质量为b,则
=1-50%,解得b=32,则Y为硫元素,所以两种化合物为SO2和SO3.
| a |
| a+2 |
元素X和Y属于同一主族,处于ⅥA族,元素X和元素Y可以形成两种化合物为YO2和YO3,YO2和YO3中O的质量分数分别为50%和60%,令Y的相对原子质量为b,则
| b |
| b+32 |
解答:
解:负二价的元素X和氢的化合物在通常情况下是一种液体,其中X的质量分数为88.9%,负二价的元素X和氢的化合物为H2X,令X的相对分子质量为a,则
=88.9%,解得a=16,所以X为氧元素;
元素X和Y属于同一主族,处于ⅥA族,元素X和元素Y可以形成两种化合物为YO2和YO3,YO2和YO3中O的质量分数分别为50%和60%,令Y的相对原子质量为b,则
=1-50%,解得b=32,则Y为硫元素,两种化合物为SO2和SO3.
(1)X为氧元素,Y为硫元素,与O、S同主族且与S相邻的Z元素在周期表中的位置为第四周期ⅥA族,
故答案为:第四周期ⅥA族;
(2)由分析可知X的质量分数为50%的化合物为SO2,中心原子S原子最外层电子未全部成键,含有孤对电子对,是由极性键形成极性分子,价层电子对数=2+
(6-2×2)=3,S原子为sP2杂化,含有一个孤电子对,所以分子构型为V形;
故答案为:SO2;极性;V形;
(3)由分析可知X的质量分数为60%的化合物为为SO3,S原子的价层电子对数=3+
(6-3×2)=3,S原子为sP2杂化,没有孤电子对,所以分子构型为平面三角形,分子结构对称,是非极性分子.
故答案为:SO3;非极性;平面三角形;
(4)由元素氢、X、Y三种元素形成的他合物常见的有两种,其水溶液均显酸性,则两种物质为H2SO4、H2SO3,酸性强弱为H2SO4>H2SO3.
故答案为:H2SO4;H2SO3;H2SO4>H2SO3.
| a |
| a+2 |
元素X和Y属于同一主族,处于ⅥA族,元素X和元素Y可以形成两种化合物为YO2和YO3,YO2和YO3中O的质量分数分别为50%和60%,令Y的相对原子质量为b,则
| b |
| b+32 |
(1)X为氧元素,Y为硫元素,与O、S同主族且与S相邻的Z元素在周期表中的位置为第四周期ⅥA族,
故答案为:第四周期ⅥA族;
(2)由分析可知X的质量分数为50%的化合物为SO2,中心原子S原子最外层电子未全部成键,含有孤对电子对,是由极性键形成极性分子,价层电子对数=2+
| 1 |
| 2 |
故答案为:SO2;极性;V形;
(3)由分析可知X的质量分数为60%的化合物为为SO3,S原子的价层电子对数=3+
| 1 |
| 2 |
故答案为:SO3;非极性;平面三角形;
(4)由元素氢、X、Y三种元素形成的他合物常见的有两种,其水溶液均显酸性,则两种物质为H2SO4、H2SO3,酸性强弱为H2SO4>H2SO3.
故答案为:H2SO4;H2SO3;H2SO4>H2SO3.
点评:本题考查根据计算推断元素、核外电子排布、分子结构与极性、物质性质等,难度中等,解题的关键是根据题目信息计算推断元素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列混合物分离(或除杂)的方法正确的是( )
| A、除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤 |
| B、除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤 |
| C、除去NaHCO3溶液中Na2CO3:加适量稀盐酸 |
| D、除去Fe2O3中的少量Al2O3:加入过量氢氧化钠溶液,过滤,洗涤 |
在恒温恒容条件下,有反应2A(g)+2B(g)?C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2mol?L-1Ⅱ.C、D的起始浓度分别为2mol?L-1和6mol?L-1.下列说法正确的是( )
| A、达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同 |
| B、达平衡时,体系内混合气体的平均密度相同 |
| C、I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同 |
| D、I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同 |
0.1mol/L CH3COONa稀溶液中,下列离子浓度关系不正确的是( )
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| C、c(CH3COO- )+c(CH3COOH)=0.1 mol/L |
| D、c(Na+)>c(CH3COO-)>c (H+)>c(OH-) |
如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )
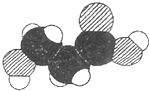

| A、分子中可能含有羟基 |
| B、分子中可能含有羧基 |
| C、该物质的分子式可能为C3H6O3 |
| D、分子中可能含有氨基 |
有甲、乙两瓶酸溶液,已知甲瓶溶液的pH=4,乙瓶溶液的pH=6,现将甲瓶溶液取出少量用蒸馏水稀释至100倍体积(温度不变),则下列叙述中正确的是( )
| A、稀释后两溶液的pH相等 |
| B、稀释后甲瓶溶液的pH一定小于乙溶液 |
| C、稀释后甲瓶溶液的pH小于或等于乙溶液 |
| D、稀释后甲瓶溶液的pH一定大于乙溶液 |
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.