题目内容
20.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行以下几项操作:①加入过量的NaOH溶液,②加入适量的HCl,③加入过量的Na2CO3溶液,④加入过量的BaCl2溶液请选出每一步所需添加试剂,并写出每一步涉及到的所有化学方程式
第一步:过滤
第二步:①(填序号),2NaOH+MgCl2=Mg(OH)2↓+2NaCl(方程式)
第三步:④(填序号),Na2SO4+BaCl2=BaSO4↓+2NaCl(方程式)
第四步:③(填序号),Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl(方程式)
第五步:②(填序号),Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O(方程式)
第六步:蒸发.
分析 粗食盐常含有少量Ca2+、Mg2+、SO42-、泥沙等杂质离子,加热溶解后,加NaOH除去Mg2+,加氯化钡除去SO42-,加碳酸钠除去Ca2+、Ba2+,碳酸钠一定在氯化钡之后,然后过滤,滤液中加盐酸除去过量碳酸钠溶液,调节pH后蒸发浓缩即可,据此回答.
解答 解:粗食盐常含有少量Ca2+、Mg2+、SO42-、泥沙等杂质离子,第一步是过滤将泥沙除去,第二步:加NaOH除去Mg2+,即2NaOH+MgCl2=Mg(OH)2↓+2NaCl,第三步:加氯化钡除去SO42-,反应为:Na2SO4+BaCl2=BaSO4↓+2NaCl,第四步加碳酸钠除去Ca2+、Ba2+,即Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl,然后过滤,滤液中加盐酸除去过量碳酸钠溶液和氢氧化钠,反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O,最后一步是蒸发,
故答案为:①;2NaOH+MgCl2=Mg(OH)2↓+2NaCl;④;Na2SO4+BaCl2=BaSO4↓+2NaCl;③;Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3+CaCl2=CaCO3↓+2NaCl;②,Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaOH+HCl=NaCl+H2O.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.

练习册系列答案
相关题目
10.为了除去粗盐中的 Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作.其中正确的操作顺序是( )
①过滤
②加过量 Ba(OH)2溶液
③加适量盐酸
④加过量 NaCO3溶液.
①过滤
②加过量 Ba(OH)2溶液
③加适量盐酸
④加过量 NaCO3溶液.
| A. | ①④②③ | B. | ④①②③ | C. | ②④①③ | D. | ④②①③ |
8. 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO的燃烧热为-566 kJ/mol |
15.在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)?Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%.若在同一容器中,最初放入的是1molY和1molZ的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中X 气体所占的体积分欲是b%.则a和b的关系是( )
| A. | a>b | B. | a=b | C. | a<b | D. | 2a=b |
5.一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:
2A(g)+B(s)?2D (g)△H<0,测得相关数据如下,分析可知下列说法不正确的是( )
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的摩尔体积比乙的摩尔体积小 | |
| B. | 甲的物质的量比乙的物质的量多 | |
| C. | 甲的相对分子质量比乙的相对分子质量小 | |
| D. | 甲的分子数比乙的分子数少 |
10.研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式SO2+H2O?H2SO3;H2SO3?H++HSO3-.
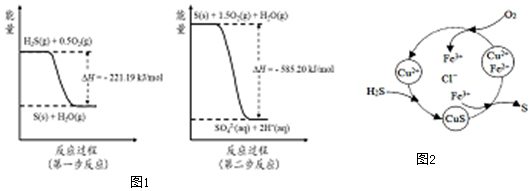
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39kJ•mol-1.
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g),过程中测定的部分数据见表:
①反应在0~4min内的平均速率为v(SO2)=6.25×10-3mol/(L•min);
②此温度下该反应的化学平衡常数K=225(mol/L),
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将减小(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有通入足量的空气.
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:K a1=1.3×10-7,K a2=7.1×10-15,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度反应很难进行.
(1)SO2的大量排放会引起严重的环境问题是酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式SO2+H2O?H2SO3;H2SO3?H++HSO3-.
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39kJ•mol-1.
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g),过程中测定的部分数据见表:
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
②此温度下该反应的化学平衡常数K=225(mol/L),
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将减小(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有通入足量的空气.
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:K a1=1.3×10-7,K a2=7.1×10-15,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度反应很难进行.


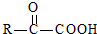 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$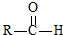 +H2O
+H2O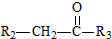 $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$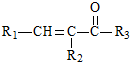 +H2O
+H2O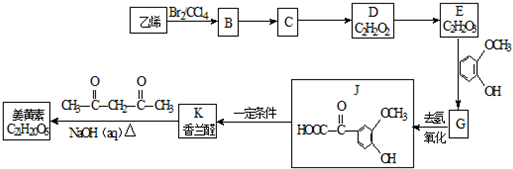
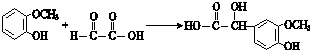 .
.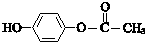
 .
.