题目内容
17.将10.5g表面氧化了的铝片投入100mLNaOH溶液中,恰好完全反应,放出氢气6.72L(标准状况下)求:(1)该样品中铝的质量是多少?
(2)该NaOH溶液的物质的量浓度是多少?
分析 根据化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑,列出铝与氢气的物质的量之间的关系,来求解;根据c=$\frac{n}{V}$来计算求解.
解答 解:n(H2)=$\frac{V}{Vm}$=$\frac{6.72L}{22.4L/mol}$=0.3mol,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 2 3
n(Al) n(NaOH) 0.3mol
$\frac{2}{n(Al)}$=$\frac{2}{n(NaOH)}$=$\frac{3}{0.3mol}$
解之得n(Al)=0.2mol,n(NaOH)=0.2mol,
所以m(Al)=0.2mol×27g/mol=5.4g,m(Al2O3)=10.5g-5.4g=5.1g,n(Al2O3)=0.05mol,与氧化铝反应的氢氧化钠的物质的量为0.1mol,所以c(NaOH)=$\frac{0.1mol+0.2mol}{0.1L}$=3mol/L,
答:(1)该样品中铝的质量是5.4g;(2)该NaOH溶液的物质的量浓度是3mol/L.
点评 本题考查铝的性质、方程式的书写、根据方程式的计算,比较基础,掌握根据方程式计算的格式,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
8.组成和结构可用 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 9种 | B. | 12种 | C. | 24种 | D. | 36种 |
5.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
| A. | 铜和浓硝酸反应 | |
| B. | 铜和稀硝酸反应 | |
| C. | 铜与空气中氧气反应得氧化铜,然后氧化铜和硝酸反应 | |
| D. | 铜和硝酸银反应 |
12.已知:C(s)+O2(g)=CO2(g)△H1
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O3(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O3(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H3<0 | B. | △H1>△H2 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
2.短周期主族元素M、N、R、T的原子半径与族序数关系如图所示,下列推断不正确的是( )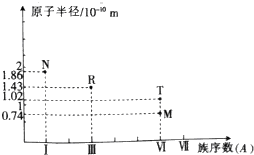

| A. | 常压下,单质R的熔点高于单质M的熔点 | |
| B. | R、T的简单离子都会破坏水的电离平衡 | |
| C. | N2M2与R2M3中所含化学键的类型完全相同 | |
| D. | N、R、T的最高价氧化物对应的水化物之间能相互反应 |
9.表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是Si和Ar.
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O.
(4)⑨最高价氧化物对应水化物的电子式 .
.
(5)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:将氯水加入溴化钠溶液中,溶液颜色加深或溶液变为橙黄色,证明有单质Br2生成,从而证明单质氯比单质溴氧化性强.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O.
(4)⑨最高价氧化物对应水化物的电子式
 .
.(5)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:将氯水加入溴化钠溶液中,溶液颜色加深或溶液变为橙黄色,证明有单质Br2生成,从而证明单质氯比单质溴氧化性强.
6.下列有关化学用语正确的是( )
| A. | N2的电子式:N??N | |
| B. | 质子数为53,中子数为78的碘原子:78131I | |
| C. | S2-的结构示意图: | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe3++SO42- |
3.下列有关化学用语表示正确的是( )
| A. | NH4Cl的电子式: | B. | 中子数为7的碳原子:13C | ||
| C. | Cl的原子结构示意图: | D. | 次氯酸的结构式:H-Cl-O |