题目内容
2.下列实验能够达到目的是( )| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4Cl三种溶液可以用加入NaOH溶液并加热的方法区分开 | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 用湿润的KI淀粉试纸可以检验溴蒸气中是否含有NO2 |
分析 A.加入浓盐酸(必要时可加热),反应现象不同;
B.(NH4)2SO4、NH4Cl加入NaOH溶液加热现象相同;
C.硝酸钾的溶解度随温度变化较大,可用重结晶的方法分离;
D.溴和NO2均可氧化碘离子.
解答 解:A.加入浓盐酸,加热条件下,二氧化锰和浓盐酸反应生成黄绿色气体,氧化铜和盐酸反应,溶液变成蓝色,铁和盐酸反应生成气体,现象不同,可鉴别,故A错误;
B.(NH4)2SO4、NH4Cl加入NaOH溶液加热都有氨气生成,无法区别,故B错误;
C.硝酸钾的溶解度随温度变化较大,除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤,析出硝酸钾,氯化钠残留在溶液中,故C正确;
D.溴和NO2均可氧化碘离子,则湿润的KI淀粉试纸不能检验溴蒸气中是否含有NO2,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及物质的检验、鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
13.为分析某铝合金(含有Mg、Si)的组成,甲、乙、丙三位同学分别称取一定质量的合金粉末,向其中加入25.0mL盐酸,实验数据如下表所示(假设反应前后溶液体积不发生变化,气体体积已折算为标准状况下体积).
请回答下列问题:
(1)甲组实验中,盐酸过量(填“过量”“适量”或“不足量”,下同);乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)混合物中Mg、Al、Si的物质的量之比为2:12:1.
(4)丙实验之后,向容器中加入一定量1.00mol/LNaOH溶液,使固体质量不再变化,求加入的NaOH溶液的体积.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 200 | 300 | 400 |
| 气体体积/Ml | 224 | 280 | 280 |
| 剩余固体/mg | 14 | 67.5 | 167.5 |
(1)甲组实验中,盐酸过量(填“过量”“适量”或“不足量”,下同);乙组实验中盐酸不足量.
(2)盐酸的物质的量浓度为1mol/L.
(3)混合物中Mg、Al、Si的物质的量之比为2:12:1.
(4)丙实验之后,向容器中加入一定量1.00mol/LNaOH溶液,使固体质量不再变化,求加入的NaOH溶液的体积.
10.下列离子方程式正确的是( )
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 等体积、等浓度的稀溶液Ba(OH)2与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
7.在FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,对溶液中阳离子(不考虑H+)的描述正确的是( )
| A. | 若容器底部没有固体,则溶液中只有Cu2+ | |
| B. | 若容器底部固体既有铜又有铁,则溶液中只有Fe2+ | |
| C. | 若容器底部固体为铜,则溶液中可能有Cu2+和Fe3+ | |
| D. | 若容器底部无固体,再加入铁粉,溶液中阳离子的种类不发生变化 |
11.有机物分子内基团间的相互影响会导致物质化学性质的不同.下列各项事实不能说明上述观点的是( )
| A. | 苯酚与溴水常温可以反应,而苯与溴水不能反应 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色 |
3.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2 (g)$\stackrel{高温}{?}$W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{3}(H{\;}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;580℃时,固体物质的主要成分为W2O5、WO2;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{3}(H{\;}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
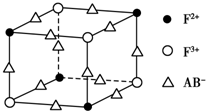 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
. 取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,
取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,