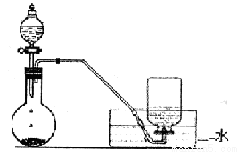
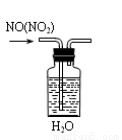题目内容
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合图。
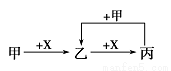
其中甲和X不可能是
A.甲为Fe,X为Cl2
B.甲为SO2,X为NaOH溶液
C.甲为C,X为O2
D.甲为AlCl3溶液,X为NaOH溶液
A
【解析】
试题分析:A、若甲是Fe,X是氯气,则乙只能是氯化铁,而氯化铁不再与氯气反应,所以此图不通,错误;B、甲是二氧化硫,X是氢氧化钠溶液,则乙是亚硫酸氢钠,亚硫酸氢钠与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与二氧化硫反应又生成亚硫酸氢钠,正确;C、甲是C,X是氧气,则乙是CO,丙是二氧化碳,二氧化碳与C在高温条件下反应生成CO,正确;D、甲为AlCl3溶液,X为NaOH溶液,则乙是氢氧化铝,氢氧化铝溶于氢氧化钠,所以丙是偏铝酸钠,偏铝酸钠与氯化铝溶液发生双水解反应生成氢氧化铝沉淀,正确,答案选A。
考点:考查物质之间相互转化的判断

(16分)
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
则该温度下反应的平衡常数K= 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正) υ(逆) (填“>” “=” 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应c中理论上原子利用率为 。
 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是 =
=
 mol
mol  mol≤ne≤
mol≤ne≤ mol
mol mol
mol  + H2O
+ H2O