题目内容
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且  的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法正确的是
A.若某温度下,反应后  =11,则溶液中
=11,则溶液中  =
=
B.参加反应的被还原的氯气为 mol
mol
C.改变温度,反应中转移电子的物质的量ne的范围: mol≤ne≤
mol≤ne≤ mol
mol
D.改变温度,产物中KClO3的最大理论产量为 mol
mol
A、C
【解析】
试题分析:在氧化还原反应中电子转移的数目相等。A.若某温度下,反应后  =11,假设n(Cl-)=11,则n(ClO-)=1,根据电子守恒可得n(ClO3-)=(11—1)÷5=2,则溶液中
=11,假设n(Cl-)=11,则n(ClO-)=1,根据电子守恒可得n(ClO3-)=(11—1)÷5=2,则溶液中  =
= ,正确;B.由于温度不同,被氧化产生的n(ClO-)、n(ClO3-)的物质的量不同,故不能确定参加反应的被氧化或还原的氯气的物质的量的多少,错误;C.若Cl2被氧化产物只有KClO,则反应中转移电子的物质的量ne的a/2mol;若Cl2被氧化产物只有KClO3,则反应方程式是6KOH+3Cl2=5KCl+KClO3+3H2O。反应中转移电子的物质的量ne是5a/6mol。故改变温度,反应中转移电子的物质的量ne的范围:
,正确;B.由于温度不同,被氧化产生的n(ClO-)、n(ClO3-)的物质的量不同,故不能确定参加反应的被氧化或还原的氯气的物质的量的多少,错误;C.若Cl2被氧化产物只有KClO,则反应中转移电子的物质的量ne的a/2mol;若Cl2被氧化产物只有KClO3,则反应方程式是6KOH+3Cl2=5KCl+KClO3+3H2O。反应中转移电子的物质的量ne是5a/6mol。故改变温度,反应中转移电子的物质的量ne的范围: mol≤ne≤
mol≤ne≤ mol,正确;D.改变温度,若氧化产物只有KClO3,根据电子守恒可知产物中KClO3的最大理论产量为a/6mol,错误。
mol,正确;D.改变温度,若氧化产物只有KClO3,根据电子守恒可知产物中KClO3的最大理论产量为a/6mol,错误。
考点:考查守恒方法在氧化还原反应中计算的应用的知识。

练习册系列答案
相关题目

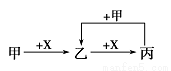

 )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。