题目内容
2.除去下列各物质中的少量杂质,其中正确的是( )| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(无水硫酸铜) | ||
| C. | 硝基苯中的混酸(NaOH溶液) | D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
分析 A.溴易溶于苯;
B.乙醇与铜离子反应;
C.硝基苯不溶于氢氧化钠溶液;
D.乙烯被氧化生成二氧化碳气体.
解答 解:A.溴易溶于苯,引入新杂质,应用蒸馏的方法分离,故A错误;
B.乙醇与铜离子反应,且无水硫酸铜吸水能力较差,一般用于检验水,故B错误;
C.硝基苯不溶于氢氧化钠溶液,且氢氧化钠可除去酸,故C正确;
D.乙烯被氧化生成二氧化碳气体,引入新杂质,应用溴水除杂,故D错误.
故选C.
点评 本题考查物质的分离除杂,为高频考点,根据原物质和杂质的性质选择适当的除杂剂和分离方法,注意既要除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,题目难度不大.

练习册系列答案
相关题目
12.某有机物的红外光谱表明有O-H键和C-H键,核磁共振氢谱有两组吸收峰,峰面积之比为2:1,该有机物可能是( )
| A. | CH2=CH-CH=CH2 | B. | HOCH2-CH2OH | C. | 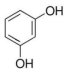 | D. | HCOOH |
13.向含有c(FeCl3)=0.3mol•L-1、c(FeCl2)=0.15mol•L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-=Fe3O4+4H2O | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |
17.下列实验操作中,错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处 | |
| C. | 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸发时,蒸发皿中出现大量固体时即停止加热 |
7.关于 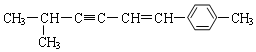 说法正确的是( )
说法正确的是( )
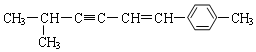 说法正确的是( )
说法正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为18个 |
11.下列溶液中有关物质的量浓度关系正确的是( )
| A. | Na2S 溶液中 c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-) | |
| C. | 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合:溶液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.1mol•L-1的NaHC2O4溶液的pH=4,则c(H C2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |





 ;
;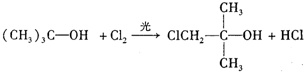 ,反应类型:取代反应;
,反应类型:取代反应; .
.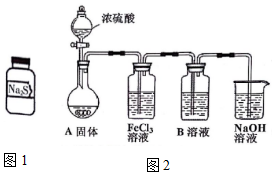 有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,
有两瓶标签已被腐蚀的药品,只看到“Na2S”字样(如图1),每瓶药品可能是Na2S、Na2SO3、Na2S2O3、Na2SiO3、Na2SO4中的一种.将两瓶药品分别标记为A、B,