题目内容
7.关于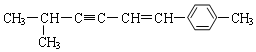 说法正确的是( )
说法正确的是( )| A. | 该分子中所有的碳原子均可能处于同一平面上 | |
| B. | 该分子中一定共面的碳原子数至少为8个 | |
| C. | 该分子中至少有9个碳原子处于同一条直线上 | |
| D. | 该分子中可能处于同一平面的原子总数最多为18个 |
分析 有机物中的原子共平面问题可以直接联想甲烷的正四面体结构、乙烯的平面型结构、乙炔的直线型结构和苯的平面型结构,对有机物进行肢解,分部分析,另外要重点掌握碳碳单键可旋转、双键和三键不可旋转,以此解答该题.
解答 解:A.此有机物中存在的C原子如图所示, ,其中与2号碳相连的3和1、8这3个碳原子为四面体结构,不可能在同一平面上,故A错误;
,其中与2号碳相连的3和1、8这3个碳原子为四面体结构,不可能在同一平面上,故A错误;
B.该分子中,碳碳三键中的3、4号碳与双键中5、6号碳一定在同一平面上,与3号碳相连的2号碳一定在这个平面内,与6号碳相连的苯环上的碳以及其对面上的碳和7号碳一定在同一平面内,故最少在同一平面内的碳原子数是8,故B正确;
C.乙炔中所有原子共直线,故最多有4个原子在一条直线上,故C错误;
D.其中甲基中最多有2个H原子与甲基所在碳的共平面,即2、3、4、5、6、7号碳以及苯环所在的原子在同一平面内,那么1、8、7号上最多有1个H在此平面内,总共有30个原子,最多有24个原子共平面,故D错误,
故选B.
点评 本题主要考查的是常见有机化合物的结构,为高频考点,侧重考查学生的分析能力,难度不大,掌握乙烯乙炔、甲烷以及苯的结构是解决本题的关键.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
17.下列溶液中微粒浓度关系一定正确的是( )
| A. | pH=7的氨水和氯化铵的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
18.下列说法中,正确的是( )
| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | 强电解质的水溶液中不存在溶质分子,弱电解质溶液中已电离的离子和未电离的分子共存 | |
| C. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| D. | 不溶性盐都是弱电解质,可溶性酸都是强电解质 |
15.能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN-;②Fe;③Fe2+;④Cu;⑤I-;⑥OH-;⑦Cl2.
①SCN-;②Fe;③Fe2+;④Cu;⑤I-;⑥OH-;⑦Cl2.
| A. | ①②④ | B. | ②④⑤ | C. | ①③⑥ | D. | ②⑤⑦ |
2.除去下列各物质中的少量杂质,其中正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(无水硫酸铜) | ||
| C. | 硝基苯中的混酸(NaOH溶液) | D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
12.下列关于实验的叙述不正确的是( )
| A. | 实验室制乙烯时,温度计水银球应插入混合液中,而石油分馏时则不能插入混合液中 | |
| B. | 实验室用溴和苯在铁粉存在下反应,得到的溴苯显褐色,可用稀NaOH溶液反复洗涤,并用分液漏斗分液 | |
| C. | 检验2-溴丙烷中的溴原子:加入NaOH水溶液共热,冷却后,用稀硝酸酸化后再滴入AgNO3溶液,观察有淡黄色沉淀生成 | |
| D. | 制取硝基苯时,应取1.5 mL浓HNO3,加入浓H2SO4 2mL,冷却至50℃以下,再滴入苯约1mL,然后放在水浴中加热,温度计应放在混合液中 |
16.下列物质变化或操作过程中发生化学变化的是( )
| A. | 硅胶作袋装食品的干燥剂 | |
| B. | 氯气作自来水杀菌消毒剂 | |
| C. | 用铂丝蘸取碳酸钠溶液在酒精灯外焰上灼烧 | |
| D. | 用蒸馏的方法除去自来水中的Cl- |
18.某溶液中Cl-、Br-、I-三者物质的量之比为1:2:3,要使溶液中Cl-、Br-、I-物质的量之比为3:2:1,则通入Cl2的物质的量是原溶液中I-的物质的量( )
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{5}$ |