题目内容
用0.2mol/L某金属阳离子Rn+的盐溶液40mL,恰好将20mL 0.4mol/L的硫酸盐中的硫酸根完全沉淀,则n值为( )
| A、1 | B、2 | C、3 | D、4 |
考点:离子方程式的有关计算
专题:计算题
分析:根据SO42-与Rn+离子反应时,恰好将溶液中的Rn+离子完全沉淀为硫酸盐,利用化合价得出Rn+离子与SO42-离子的关系,然后利用物质的量来计算解答.
解答:
解:溶液中SO42-离子的物质的量为:20mL×10-3×0.4mol?L-1=8×10-3 mol,
溶液中Rn+离子的物质的量为:40mL×10-3×0.2mol?L-1=8×10-3mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐及M的化合价为+n,
则SO42-与Rn+反应对应的关系式为:
2Rn+~n SO42-
2 n
8×10-3mol 8×10-3mol
解得n=2,
故选:B.
溶液中Rn+离子的物质的量为:40mL×10-3×0.2mol?L-1=8×10-3mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐及M的化合价为+n,
则SO42-与Rn+反应对应的关系式为:
2Rn+~n SO42-
2 n
8×10-3mol 8×10-3mol
解得n=2,
故选:B.
点评:本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可.

练习册系列答案
相关题目
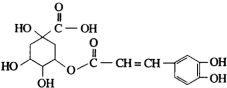 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与7molNaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
在无色溶液中能大量共存的离子组是( )
| A、Cu2+、SO42-、Ba2+、Cl- |
| B、Ca2+、Na+、NO3-、CO32- |
| C、Cl-、H+、Na+、CO32- |
| D、Na+、NO3-、K+、SO42- |
用足量的CO还原32.0g某铁氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是( )
| A、FeO |
| B、Fe2O3 |
| C、Fe3O4 |
| D、无法计算 |
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、Na+、Ba2+、SO42- |
| B、Ag+、K+、NO3- |
| C、Ba2+、HCO3-、NO3- |
| D、Na+、NO3-、CO32- |
0.3mol Cu2S与足量的浓硝酸反应,生成硝酸铜、硫酸、二氧化氮和水.则参加反应的硝酸中,被还原的硝酸的物质的量为( )
| A、0.6mol |
| B、1.2mol |
| C、2.2mol |
| D、3.0mol |
在NO2与水的反应中,NO2( )
| A、只是还原剂 |
| B、只是氧化剂 |
| C、既是还原剂,又是氧化剂 |
| D、既不是还原剂,又不是氧化剂 |