题目内容
8.在实验实里,欲用98%的浓硫酸(密度为1.84g/mL)配制成浓度为0.5mol/L的稀硫酸500mL.用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和500ml容量瓶;所需浓硫酸的体积为13.6mL(保留到小数点后一位);如果实验室有15mL、20mL、50mL的量筒,应选用15mL.分析 依据配置步骤选择合适的仪器;依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据稀释前后溶液含溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适的量筒,据此分析.
解答 解:配制稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,需要使用的仪器有量筒,烧杯,玻璃棒,胶头滴管,500ml容量瓶,故还需要500mL容量瓶;C=$\frac{1000×1.84g/mL×98%}{98g/mol}$=18.4mol/L,稀释前后溶液含溶质的物质的量不变,设需要浓硫酸体积为V,则V×18.4mol/L=0.5mol/L×500mL,
解得:V=13.6ml,所以需要浓硫酸13.6mL,应选择15mL的量筒.
故答案为:500ml容量瓶;13.6;15.
点评 本题考查了配制一定物质的量浓度的溶液的方法,侧重对学生能力的培养和解题方法的指导和训练,熟悉配置原理和过程是解题关键,注意物质的量浓度与质量百分数浓度之间的换算.

练习册系列答案
相关题目
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | |
| B. | 稀硫酸中:K+、Mg2+、AlO2-、S2O32- | |
| C. | 常温下:$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入硫氰化钾显红色的溶液:K+、NH4+、Cl-、I- |
19.分类是学习化学常用的方法,下列关于物质的分类说法正确的是( )
| A. | CO2、SO2、CO都是酸性氧化物 | B. | Na2O、Al2O3、CuO都是碱性氧化物 | ||
| C. | HCl、HClO、HClO4都是强酸 | D. | CH3COOH、HNO3、HSCN都是一元酸 |
16.某温度下,测得纯水中的c(H+)=2×10-7 mol/L,则c(OH-)为( )
| A. | 2×10-7 mol/L | B. | 0.1×10-7 mol/L | C. | 0.5×10-7 mol/L | D. | 无法确定 |
3.在加热时,浓硫酸与铜发生反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.对于该反应,下列说法不正确的是( )
| A. | 是氧化还原反应 | B. | 铜是还原剂 | ||
| C. | 部分H2SO4被还原 | D. | Cu发生了还原反应 |
13.下列关于SO2的说法中,不正确的是( )
| A. | 能使品红溶液褪色 | B. | 能使石蕊试液先变红再褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能使滴有酚酞的NaOH溶液褪色 |
18.80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20~40s 内用N2O4表示的平均反应速率为0.002 mol•L-1•s-1.
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=1.8.
(3)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4 起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度.
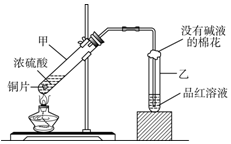 用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.