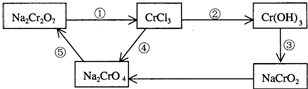
题目内容
4.瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,则下列说法正确的是( )| A. | 此时甲烷与氧气的体积比为2:1 | |
| B. | 此时混合气体的平均相对分子质量约为26.7 | |
| C. | 此时混合气体中C、H、O原子的个数比为1:4:2 | |
| D. | 应在较为密闭的环境中使用瓦斯炉 |
分析 令甲烷与氧气的质量分别为1g、4g,根据n=$\frac{m}{M}$计算各自的物质的量.
A、相同条件下,体积之比等于物质的量之比,据此计算;
B、气体的平均相对分子质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$;
C、根据甲烷的分子式为CH4,氧气的分子式为O2,并结合两者的物质的量之比来计算;
D、瓦斯的主要成分为甲烷,而甲烷不完全燃烧会生成CO.
解答 解:令甲烷与氧气的质量分别为1g、4g,则:甲烷的物质的量为$\frac{1}{16}$mol,氧气的物质的量为:$\frac{4g}{32g/mol}$=$\frac{1}{8}$mol.
A、相同条件下,体积之比等于物质的量之比,故此时甲烷与氧气的体积比为$\frac{1}{16}$mol:$\frac{1}{8}$mol=1:2,故A错误;
B、混合气体的平均摩尔质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$=$\frac{5g}{\frac{1}{16}mol+\frac{1}{8}mol}$=26.7g/mol,而平均相对分子质量在数值上等于摩尔质量,故混合气体的平均相对分子质量为26.7,故B正确;
C、甲烷的物质的量为$\frac{1}{16}$mol,氧气的物质的量为$\frac{1}{8}$mol,故混合气体中含$\frac{1}{16}$molC原子,含$\frac{1}{4}$molH原子,含$\frac{1}{4}$mol氧原子,故C、H、O原子的个数之比为1:4:4,故C错误;
D、瓦斯的主要成分为甲烷,而甲烷不完全燃烧会生成CO,故若在比较密闭的环境中使用瓦斯炉,会导致甲烷的不完全燃烧,生成有毒的CO,故D错误.
故选B.
点评 考查常用化学计量的有关计算,比较基础,注意公式的掌握与灵活运用.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1mol NH4Cl | B. | 0.1mol NH4NO3 | ||
| C. | 1.204×1023个CO(NH2)2 | D. | 0.2mol NH3•H2O |
| A. | 大理石和稀硫酸制取二氧化碳 | B. | 锌粒和稀硫酸制氢气 | ||
| C. | 块状碳酸钠和稀盐酸制取二氧化碳 | D. | 氯酸钾和二氧化锰制取氧气 |
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | |||||
| 其他 | 阳离子 核外无电子 | 无机非金属材料的主角 | 焰色反 应呈黄色 |
(2)R 元素的单质与水反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(3)Z 与 Q 相比,金属性较强的是Na(用元素符号表示),下列事实能证明这一 结论的是bc(填字母序号).
a.Q 的熔点比 Z 的熔点高,Q 的硬度比 Z 的硬度大
b.Z 与冷水反应迅速,而 Q 与冷水几乎不反应
c.Z 的最高价氧化物对应水化物是强碱,而 Q 的最高价氧化物对应水化物具有两性
(4)与 Y 元素同主族的短周期元素 E 在自然界中存在多种核素,它们之间的关系互为同位素,其中用于测定一些文物年代的核素的符号为146C(或14C).
(5)写 出 Z2M2与 X2M 反 应 的 化 学 方 程 式 并 标 出 电 子 转 移 关 系
 .
.