题目内容
8.下列说法不正确的是( )| A. | 新制氯水中存在两种电离平衡 | |
| B. | 不同原子之间形成的共价键不一定是极性共价键 | |
| C. | 向久置于空气中的Na2SiO3、NaOH、CaCl2、漂白粉溶液里加足量盐酸,都能产生气体 | |
| D. | 将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡. |
分析 A.新制氯水中存在水的电离平衡、次氯酸的电离平衡;
B.不同种元素之间形成的共价键一定是极性共价键,不同的原子可能是同一元素;
C.硅酸钠和盐酸反应生成硅酸沉淀,和氢氧化钠溶液反应生成盐和水,和氯化钙不发生反应,漂白粉中加入盐酸发生归中反应生成氯气;
D.氯化亚铁在酸性溶液被过氧化氢氧化生成氯化铁溶液,氯化铁对过氧化氢起到催化剂作用,过氧化氢分解生成氧气和水.
解答 解:A.新制氯水中存在水的电离平衡H2O?H++OH-,次氯酸的电离平衡HClO?H++ClO-,新制氯水中存在两种电离平衡,故A正确;
B.不同种元素之间形成的共价键一定是极性共价键,不同的原子可能是同一元素,故B正确;
C.硅酸钠和盐酸反应生成硅酸沉淀,和氢氧化钠溶液反应生成盐和水,和氯化钙不发生反应,漂白粉中加入盐酸发生归中反应生成氯气,不能都产生气体,故C错误;
D.氯化亚铁在酸性溶液被过氧化氢氧化生成氯化铁溶液,2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑,将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡,故D正确;
故选C.
点评 本题考查了物质性质、氧化还原反应、电离平衡等知识点,注意知识积累,题目较简单.

练习册系列答案
相关题目
18.某化工厂利用原电池原理处理废水并淡化海水.工作示意图如下.下列说法正确的是( )

| A. | 电极a在装置中做正极 | |
| B. | 装置中膜A是阳离子交换膜 | |
| C. | 电极b的电极反应式是2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 若有机物表示为C4H8O2,每转移10mol电子,电极a上产生22.4LCO2(标准状况) |
16.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、戊烷、硝基苯 | B. | 苯、四氯化碳、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 甲醇、乙酸乙酯、乙酸 |
13.复盐M【K3Fe(A2B4)3•3H2O】可用于蓝色印刷和摄影,某小组同学将纯净的化合物M在一定条件下加热分解,对所得其他产物和固体产物进行实验和探究.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.

(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.
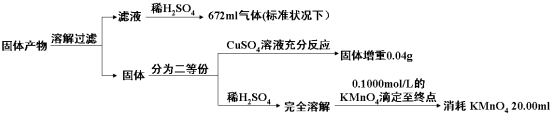
判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
(4)通过以上结论,复盐M加热分解的反应方程式为2K3Fe(C2O4)3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3K2CO3+Fe+FeO+5CO2↑+4CO↑+6H2O.
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为
 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.

判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
| 固体产物中的成分 | K2AB3 | … | ||
| 物质的量之比 | ||||
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
20.下列关于硫及其化合物的说法中正确的是( )
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| C. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| D. | 浓硫酸可用来干燥H2S、CO、Cl2等气体 |
18.核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为:
已知: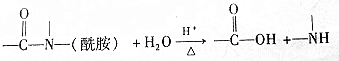
有关核黄素的下列说法中,正确的是( )

已知:
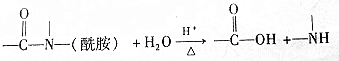
有关核黄素的下列说法中,正确的是( )
| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
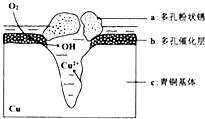 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题: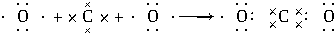 ,用电子式表示C、D两元素形成化学键的过程:
,用电子式表示C、D两元素形成化学键的过程: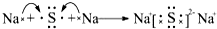 .
.