题目内容
18.某化工厂利用原电池原理处理废水并淡化海水.工作示意图如下.下列说法正确的是( )
| A. | 电极a在装置中做正极 | |
| B. | 装置中膜A是阳离子交换膜 | |
| C. | 电极b的电极反应式是2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 若有机物表示为C4H8O2,每转移10mol电子,电极a上产生22.4LCO2(标准状况) |
分析 A、根据图象知,a为负极;
B、A为阴离子交换膜;
C、b正极,在原电池的正极上发生得电子的还原反应;
D、根据得失电子数来回答.
解答 解:A.根据图象知,a产生二氧化碳,为负极,故A错误;
B.a电极是负极,故A膜为阴离子交换膜,故B错误;
C.电极b为正极,电极反应式是2NO3-+10e-+12H+═N2↑+6H2O,故C正确;
D.若有机物表示为C4H8O2,每生成1mol二氧化碳,转移5mol电子,则每转移10mol电子,产生2mol二氧化碳,电极a上产生44.8LCO2(标准状况),故D错误.
故选:C.
点评 本题考查学生原电池的工作原理知识的,注意电极反应的书写是关键,难度中等.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
8.下列说法中不正确的是( )
| A. | 电子数相同的粒子不一定属于同种元素 | |
| B. | 两个原子如果核外电子排布相同,一定属于同种元素 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 所含质子数和电子数相等的粒子一定是原子 |
9.有机物A与氢气的相对密度是38,称取有机物A 7.6g完全燃烧后,生成8.8g CO2和3.6gH2O.此有机物能与碳酸氢钠反应,但不能发生水解.下列有关A的说法中不正确的是( )
| A. | A的分子式为C2H4O3 | |
| B. | A的结构简式为HOCH2COOH | |
| C. | A分子中的官能团有两种 | |
| D. | 1 mol A与足量的单质Na反应时放出H2的物质的量为0.5mol |
6.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色.向反应后溶液中通入过量SO2,溶液变成无色.下列说法错误的是( )
| A. | 滴加KI溶液时,KI被氧化,CuI是还原产物 | |
| B. | 通入SO2后,溶液变无色,体现SO2的还原性 | |
| C. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| D. | 整个过程发生了复分解反应和氧化还原反应 |
3.下列离子组在一定条件下能大量共存,且加入相应试剂后发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| B | Fe3+、I-、ClO- | 少量NaOH溶液 | Fe3++3OH-=Fe(OH) 3↓ |
| C | Ca2+、Na+、OH- | 少量NaHCO3溶液 | HCO3-+OH-=CO32-+H2O |
| D | NH4+、HCO3-、Cl- | 少量NaOH溶液 | NH4++OH-=NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
10.用含Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下: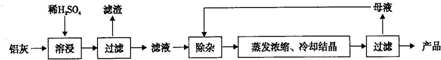
(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
Ⅰ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3.2;
Ⅱ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅲ.加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的是将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成.
③Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
Ⅰ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3.2;
Ⅱ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅲ.加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的是将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成.
③Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).
8.下列说法不正确的是( )
| A. | 新制氯水中存在两种电离平衡 | |
| B. | 不同原子之间形成的共价键不一定是极性共价键 | |
| C. | 向久置于空气中的Na2SiO3、NaOH、CaCl2、漂白粉溶液里加足量盐酸,都能产生气体 | |
| D. | 将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡. |


 .
. .
. (任写一种)
(任写一种) .
.