题目内容
下列关于中和热的说法中正确的是( )
| A、10L 0.05mol?L-1Ba(OH)2溶液与20L0.05mol?L-1HNO3反应时的反应热是中和热 |
| B、1molHCl气体通入1L 0.01mol?L-1NaOH溶液中反应时的反应热是中和热 |
| C、1molHClO与2molNaOH溶液反应时的反应热也可能是中和热 |
| D、只要强酸与强碱在衡溶液中反应生成1mol水时的反应热就是中和热 |
考点:中和热
专题:
分析:中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,依此解答.
解答:
解:A.10 L 0.05 mol?L-1Ba(OH)2溶液与20 L 0.05 mol?L-1 HNO3反应生成1mol水,放出的热量就是中和热,故A正确;
B.1 mol HCl气体通入1 L 0.01 mol?L-1 NaOH溶液中反应的热效应除了中和热外还有HCl气体的溶解热和电离热效应,故B错误;
C.HClO为弱酸,电离时需要吸收热量,所以1 mol HClO与2 mol NaOH溶液反应时的反应热不是中和热,故C错误;
D.如果是硫酸与氢氧化钡反应,它们反应除生成水外还会生成硫酸钡沉淀,放出更多热量,故D错误,
故选:A.
B.1 mol HCl气体通入1 L 0.01 mol?L-1 NaOH溶液中反应的热效应除了中和热外还有HCl气体的溶解热和电离热效应,故B错误;
C.HClO为弱酸,电离时需要吸收热量,所以1 mol HClO与2 mol NaOH溶液反应时的反应热不是中和热,故C错误;
D.如果是硫酸与氢氧化钡反应,它们反应除生成水外还会生成硫酸钡沉淀,放出更多热量,故D错误,
故选:A.
点评:本题主要考查了中和热的概念的理解,解题式应注意分析中和热时①稀溶液②强酸强碱③生成1mol水,难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列说法正确的是( )
| A、新制氯水中加入固体NaOH,则:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,溶液的PH减小 |
| C、常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
对于反应2SO2(g)+O2(g)?2SO3(g)△H<0,下列判断正确的是( )
| A、2体积SO2和足量O2反应,必定生成2体积SO3 |
| B、其他条件不变,增大压强,平衡必定向右移动 |
| C、平衡时,SO2消耗速率必定等于O2的生成速率 |
| D、平衡时,SO2浓度必定等于O2浓度的两倍 |
 图是最简单的铜-锌原电池.对于该原电池,下列说法中不正确的是( )
图是最简单的铜-锌原电池.对于该原电池,下列说法中不正确的是( )①Zn为正极,Cu为负极.
②电解质溶液的pH不变.
③电子流动方向为:Zn→Cu.④Cu极上有H2生成.
⑤若有1mol电子流过导线,则产生H2 0.5mol.
⑥该原电池生成氢气的速度比没有连导线时慢.
| A、①②③ | B、③④⑤ |
| C、①②⑥ | D、④⑤⑥ |
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
| A、2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ?mol-1 | ||
| C、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ?mol-1 | ||
D、
|
下列各物质中所含原子个数由大到小的顺序排列正确的是( )
(1)0.5mol NH3(2)1mol Ne (3)9g H2O (4)0.2mol H3PO4.
(1)0.5mol NH3(2)1mol Ne (3)9g H2O (4)0.2mol H3PO4.
| A、(1)(4)(3)(2) |
| B、(4)(3)(2)(1) |
| C、(2)(3)(4)(1) |
| D、(1)(4)(2)(3) |
以下有关化学用语描述正确的是( )
| A、Mg2+的电子排布式:1s22s22p63s2 |
B、NH4Cl的电子式: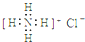 |
| C、乙烯的结构简式:C2H4 |
| D、氨气的空间结构:三角锥形 |
下列实验操作中正确的是( )
| A、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| B、Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |