题目内容
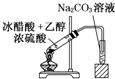
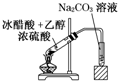
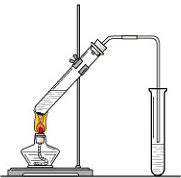 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(2)实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:
①图中左试管中为乙醇、乙酸和浓硫酸的混合液,其中浓硫酸的作用是
②制得的乙酸乙酯中常含有杂质,通常可用
(3)写出制取乙酸乙酯的化学方程式
考点:乙酸乙酯的制取
专题:实验题
分析:(1)当可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率等于化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;
(2)①浓硫酸能够加快酯化反应速率,起到了催化剂的作用,酯化反应为可逆反应,浓硫酸吸收水,有利于酯的生成,又起到了吸水剂的作用;导管不能插入液面以下的目的是防止倒吸;
②制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液分层,可以通过分液操作分离出乙酸乙酯,分液操作主要的玻璃仪器为分液漏斗;
(3)乙酸和乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,据此写出反应的化学方程式.
(2)①浓硫酸能够加快酯化反应速率,起到了催化剂的作用,酯化反应为可逆反应,浓硫酸吸收水,有利于酯的生成,又起到了吸水剂的作用;导管不能插入液面以下的目的是防止倒吸;
②制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;乙酸乙酯不溶于饱和碳酸钠溶液,所以混合液分层,可以通过分液操作分离出乙酸乙酯,分液操作主要的玻璃仪器为分液漏斗;
(3)乙酸和乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,据此写出反应的化学方程式.
解答:
解:(1)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;
②单位时间里,生成1mol乙酸乙酯表示正反应速率,生成1mol乙酸表示逆反应速率,等于化学计量数之比,说明到达平衡,故②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明到达平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,反应到达平衡状态,故⑤正确.
故选:②④⑤;
(2)①酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂,吸水剂;
液面如果摄入液面以下,容易发生倒吸现象,所以装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸,
故答案为:催化剂、吸水剂;倒吸;
②由于饱和碳酸钠溶液可以除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,所以制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯;乙酸乙酯不溶于碳酸钠溶液,混合液会分层,可以通过分液操作从混合液中分离出乙酸乙酯;分液操作用到的主要玻璃仪器为分液漏斗,
故答案为:饱和碳酸钠溶液;分液;分液漏斗;
(3)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为CH3COOH+CH3CH2OH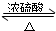 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH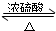 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
②单位时间里,生成1mol乙酸乙酯表示正反应速率,生成1mol乙酸表示逆反应速率,等于化学计量数之比,说明到达平衡,故②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明到达平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,反应到达平衡状态,故⑤正确.
故选:②④⑤;
(2)①酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂,吸水剂;
液面如果摄入液面以下,容易发生倒吸现象,所以装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸,
故答案为:催化剂、吸水剂;倒吸;
②由于饱和碳酸钠溶液可以除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,所以制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯;乙酸乙酯不溶于碳酸钠溶液,混合液会分层,可以通过分液操作从混合液中分离出乙酸乙酯;分液操作用到的主要玻璃仪器为分液漏斗,
故答案为:饱和碳酸钠溶液;分液;分液漏斗;
(3)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为CH3COOH+CH3CH2OH
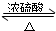 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,故答案为:CH3COOH+CH3CH2OH
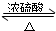 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
点评:本题考查乙酸乙酯的制备方法及反应原理、化学平衡状态的判断,题目难度中等,注意掌握乙酸乙酯的反应原理及实验室制法,明确浓硫酸、饱和碳酸钠溶液的作用及化学平衡状态的判断方法是解答本题的关键.

练习册系列答案
相关题目
下列说法正确的是( )
| A、原子及其离子的核外电子层数等于该元素所在的周期数 |
| B、元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 |
| C、稀有气体原子的最外层电子数都是8 |
| D、同一元素的各种同位素的物理性质、化学性质均相同 |
下列物质中含有非极性共价键的是( )
| A、NaOH |
| B、Na2O |
| C、Na2O2 |
| D、CaCl2 |
下列离子方程式或化学反应方程式与所述事实相符且正确的是( )
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+QkJ/mol |
| B、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |

 某学生设计了一套验证物质化学性质的实验装置(如图),请观察该装置图,完成下列问题:
某学生设计了一套验证物质化学性质的实验装置(如图),请观察该装置图,完成下列问题: