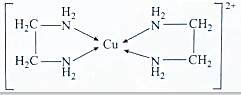
题目内容
2.天律港爆炸时泄漏出NaCN,在检测水中的CN-时,可用二氧化氯将氰化物氧化成二氧化碳和氮气.某实验小组用如图装置进行实验,以测定CN-的浓度.反应原理:5NaClO2+4HCl=4ClO2+5NaCl+2H2O
(已知:二氧化氯易溶于水,与碱溶液反应生成亚氯酸盐和氯酸盐)
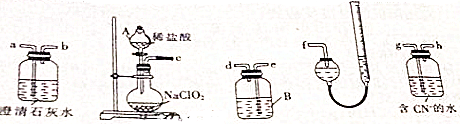
(1)仪器A的名称为分液漏斗
(2)根据气体由左至口,仪器接口的顺序为c接g,h接e,d接a,b接f(填字母)
(3)装置B中放入的试剂是氢氧化钠溶液,其作用是除去生成的混合气体中的二氧化碳
(4)澄清石灰水的作用是检验混合气体中二氧化碳是否除尽
(5)若取含CN-的污水样品1000mL进行试验,量气管前后读数如图所示(气体体积折算为标准状况下的体积),则该实验中测得的CN-的浓度6.5mg•L-1,若量气后读数如图3,则该实验中测得的CN-浓度将偏高(填“偏高”或“偏低”)

分析 根据题意,用NaClO2和HCl反应制得ClO2,用二氧化氯将氰化物氧化成二氧化碳和氮气,将生成的气体用氢氧化钠溶液吸收二氧化碳,再用澄清石灰水检验二氧化碳是否吸收干净,再用排水法测得氮气的体积,根据氮元素守恒可计算出CN-的浓度,
(1)根据装置图可知A的仪器名称;
(2)根据上面的分析可知仪器的连接顺序;
(3)二氧化氯将氰化物氧化成二氧化碳和氮气,为了测得氮气的体积,要除去生成的混合气体中的二氧化碳,要用氢氧化钠溶液;
(4)用澄清石灰水可以检验混合气体中二氧化碳是否除尽;
(5)根据图示可知,收集得的气体体积为10.0mL-7.2mL=2.8mL,所以氮气的物质的量为$\frac{2.8mL}{22.4L/mol}$=1.25×10-4 mol,根据氮元素守恒可知CN-的物质的量,进而确定CN-的浓度,如果量气后读数仰视刻度线,则读得的氮气的体积偏大,据此分析;
解答 解:根据题意,用NaClO2和HCl反应制得ClO2,用二氧化氯将氰化物氧化成二氧化碳和氮气,将生成的气体用氢氧化钠溶液吸收二氧化碳,再用澄清石灰水检验二氧化碳是否吸收干净,再用排水法测得氮气的体积,根据氮元素守恒可计算出CN-的浓度,
(1)根据装置图可知A的仪器名称为分液漏斗,
故答案为:分液漏斗;
(2)根据上面的分析可知仪器的连接顺序为:c接g,h接e,d接a,b接f,
故答案为:c接g,h接e,d接a,b接f;
(3)二氧化氯将氰化物氧化成二氧化碳和氮气,为了测得氮气的体积,要除去生成的混合气体中的二氧化碳,要用氢氧化钠溶液,所以装置B中放入的试剂是氢氧化钠溶液,
故答案为:氢氧化钠溶液;除去生成的混合气体中的二氧化碳;
(4)用澄清石灰水可以检验混合气体中二氧化碳是否除尽,
故答案为:检验混合气体中二氧化碳是否除尽;
(5)根据图示可知,收集得的气体体积为10.0mL-7.2mL=2.8mL,所以氮气的物质的量为$\frac{2.8mL}{22.4L/mol}$=1.25×10-4 mol,根据氮元素守恒可知CN-的物质的量为2.5×10-4 mol,所以CN-的浓度为$\frac{2.5×10{\;}^{-4}mol×26g/mol}{1L}$=6.5mg/L,如果量气后读数仰视刻度线,则读得的氮气的体积偏大,会导致实验中测得的CN-浓度将偏高,
故答案为:6.5;偏高.
点评 本题考查物质组成与含量的测定、对实验原理与装置理解与评价、阅读获取信息的能力等,难度中等,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,学习中全面把握基础知识.

 名校课堂系列答案
名校课堂系列答案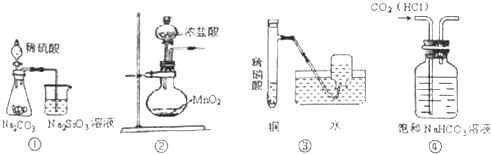
| A. | 图①可证明酸性强弱:H2SO4>H2CO3>H2SiO3 | |
| B. | 图②可用于实验室制备少量氯气 | |
| C. | 图③可用于实验室制备少量NO气体 | |
| D. | 图④可除去CO2中少量HCl气体 |
| A. | 常温常压下,2gH2含有的氢原子数目为2NA | |
| B. | 标准状况下,22.4LCCl4中含有的分子数为NA | |
| C. | 标准状况下,20gD2O中含有的电子数为10NA | |
| D. | 常温常压下,1mol•L-1K2CO3溶液中含有的钾离子数目为2NA |
| A. | 标准状况下,22.4L D2中所含中子数为2NA | |
| B. | 1 molCO2与1L 2mol/L的NaOH溶液反应后,溶液中的CO32-数为0.5 NA | |
| C. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 3.36L氯气与2.7g铝充分反应,转移电子数一定为0.3NA |
| A. | 福尔马林可使蛋白质变性,故可浸制标本 | |
| B. | 海水提取溴、煤的液化、纯碱去油污都发生了化学变化 | |
| C. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 | |
| D. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 |
| A. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| B. | 含有羟基的化合物属于醇类 | |
| C. | 羟基跟链烃基直接相连的化合物属于醇类 | |
| D. | 分子内含有苯环和羟基的化合物都属于酚类 |
| A. | 淀粉、纤维素和蛋白质均属于高分子化合物 | |
| B. | 用漂白粉漂白时,向水溶液中加几滴白醋,会增强漂白效果 | |
| C. | 利用乙醇的还原性以及Cr3+、Cr2O7-的颜色差异来检验酒后驾车 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
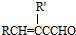 +H2O(R、R′表示烃基或氢),高分子化合物PVB的合成就是其一种重要应用.
+H2O(R、R′表示烃基或氢),高分子化合物PVB的合成就是其一种重要应用.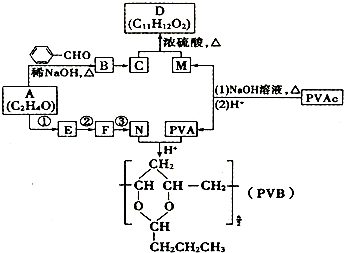

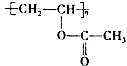
 合成B的化学方程式是
合成B的化学方程式是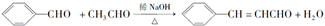 .
. .
.