题目内容
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现取三份100mL溶液进行如下实验:
①第一份溶液加入硝酸银溶液有沉淀生成
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是 .
(2)试确定一定存在的阴离子及其浓度(可不填满)
离子符号 ,浓度 .离子符号 ,浓度 .
(3)试确定K+是否存在 (填“是”或“否”)理由是: .
①第一份溶液加入硝酸银溶液有沉淀生成
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是
(2)试确定一定存在的阴离子及其浓度(可不填满)
离子符号
(3)试确定K+是否存在
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、SO42-;
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,0.02mol气体为氨气,溶液中一定含有NH4+,并且物质的量为0.02mol,无沉淀,说明原溶液中无Fe3+、Mg2+;
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明存在Al3+,1.02g为氧化铝;
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g,沉淀为硫酸钡,说明原溶液存在SO42-,一定不存在Ba2+,再根据电荷守恒,得出一定存在钾离子,据此进行解答.
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,0.02mol气体为氨气,溶液中一定含有NH4+,并且物质的量为0.02mol,无沉淀,说明原溶液中无Fe3+、Mg2+;
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明存在Al3+,1.02g为氧化铝;
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g,沉淀为硫酸钡,说明原溶液存在SO42-,一定不存在Ba2+,再根据电荷守恒,得出一定存在钾离子,据此进行解答.
解答:
解:①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、SO42-;
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,0.02mol气体为氨气,溶液中一定含有NH4+,并且物质的量为0.02mol,无沉淀,说明原溶液中无Fe3+、Mg2+;
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明存在Al3+,1.02g为氧化铝,铝离子物质的量为:
×2=0.02mol;
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g,沉淀为硫酸钡,说明原溶液存在SO42-,物质的量为:
=0.05mol,故原溶液中一定存在SO42-,则一定没有Ba2+,
再根据电荷守恒,正电荷为:n(+)=n(NH4+)+3n(Al3+)=0.02mol+3×0.02mol=0.08mol;n(-)=2n(SO42-)=0.10mol,正电荷总物质的量小于于负电荷,故原溶液中一定有K+,至少为0.02mol;不能确定是否存在Cl-,
依据以上分析得出:
(1)一定不存在的离子是Fe3+、Mg2+、Ba2+,不能确定是否存在的离子是Cl-,故答案为:Fe3+、Mg2+、Ba2+;
(2)依据c=
计算得出c(SO42-)=
=0.5mol/L,故答案为:c(SO42-),0.5mol/L;
(3)依据电荷守恒得出一定存在钾,故答案为:是;依据电荷守恒,K+一定存在.
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,0.02mol气体为氨气,溶液中一定含有NH4+,并且物质的量为0.02mol,无沉淀,说明原溶液中无Fe3+、Mg2+;
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明存在Al3+,1.02g为氧化铝,铝离子物质的量为:
| 1.02g |
| 102g/mol |
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g,沉淀为硫酸钡,说明原溶液存在SO42-,物质的量为:
| 11.65g |
| 233g/mol |
再根据电荷守恒,正电荷为:n(+)=n(NH4+)+3n(Al3+)=0.02mol+3×0.02mol=0.08mol;n(-)=2n(SO42-)=0.10mol,正电荷总物质的量小于于负电荷,故原溶液中一定有K+,至少为0.02mol;不能确定是否存在Cl-,
依据以上分析得出:
(1)一定不存在的离子是Fe3+、Mg2+、Ba2+,不能确定是否存在的离子是Cl-,故答案为:Fe3+、Mg2+、Ba2+;
(2)依据c=
| n |
| V |
| 0.05mol |
| 0.1L |
(3)依据电荷守恒得出一定存在钾,故答案为:是;依据电荷守恒,K+一定存在.
点评:本题考查常见阴、阳离子的检验方法,题目难度中等,注意掌握常见离子的化学性质及检验方法,本题中根据电荷守恒判断钾离子的存在为易错点,做题时需要细致分析.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
常温下,往H2O2溶液滴加少量FeSO4溶液,可发生如下两个反应:下列说法正确的是 ( )
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++H2O2=2Fe2++O2↑+2H+.
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++H2O2=2Fe2++O2↑+2H+.
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B、在H2O2分解过程中,溶液的H+浓度逐渐下降 |
| C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| D、H2O2生产过程中往往需要加入少量Fe2+以提高产率 |
某研究性小组讨论甲乙丙丁四种仪器的用法,其中合理的是( )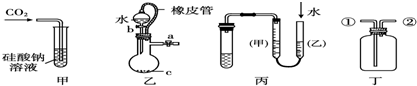

| A、甲装置:可用来证明碳酸的酸性比硅酸强 |
| B、乙装置:c为二氧化硅可制硅酸 |
| C、丙装置:可进行氢氟酸与二氧化硅的反应并测定气体体积 |
| D、丁装置:从②口进气可用于收集二氧化碳 |
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A、c(HCOO-)>c(Na+) |
| B、c(HCOO-)<c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、无法确定c(HCOO-)与c(Na+)的关系 |

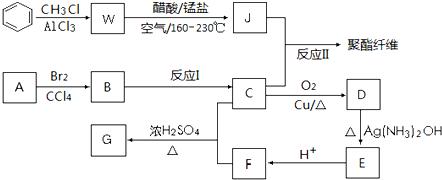
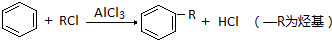



 )的合成路线(不超过四步)(合成路线常用的表示方式为:A
)的合成路线(不超过四步)(合成路线常用的表示方式为:A