题目内容
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
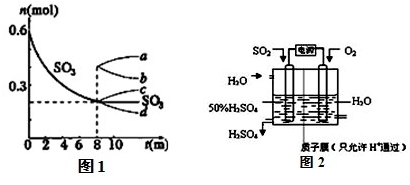
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线.
①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)?2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母).
②如表为不同温度(T)下,反应2SO2(g)+O2(g)?2SO3(g) (△H<0)的化学平衡常数(K)
由此推知,温度最低的是 (填“T1”、“T2”或“T3”).
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 .
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为 .

(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线.
①平衡时,SO3的转化率为
②如表为不同温度(T)下,反应2SO2(g)+O2(g)?2SO3(g) (△H<0)的化学平衡常数(K)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为
考点:化学平衡的计算,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:依据化学平衡三段式列式计算,在容积为1L密闭容器中充入0.6molSO3,由图1平衡时SO3物质的量为0.2mol.
2SO2+O2?2SO3,
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
(1)①转化率=
×100%;根据K=
计算;其他条件不变,在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大;
②根据反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大来分析;
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则平衡向逆反应方向移动,即Qc>K据此计算;
(2)电解原理:使电流通过电解质溶液,而在阴、阳两极引起氧化还原反应的过程,阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应,分析出氧化剂、还原剂,结合电解质溶液,正确书写出电极反应.
2SO2+O2?2SO3,
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
(1)①转化率=
| 消耗量 |
| 起始量 |
| c(SO 3) 2 |
| c(SO 2) 2c(O 2) |
②根据反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大来分析;
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则平衡向逆反应方向移动,即Qc>K据此计算;
(2)电解原理:使电流通过电解质溶液,而在阴、阳两极引起氧化还原反应的过程,阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应,分析出氧化剂、还原剂,结合电解质溶液,正确书写出电极反应.
解答:
解:在容积为1L密闭容器中充入0.6molSO3,由图1平衡时SO3物质的量为0.2mol.
2SO2+O2?2SO3,
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
(1)①SO3的转化率为=
×100%≈66.7%;K=
=
=1.25;其他条件不变,在8min时压缩容器体积至0.5L,平衡向正反应方向移动,n(SO3)变大,即为图象c,故答案为:66.7%;1.25; c;
②因为反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大,所以温度最低的为K最大的,即T2,故答案为:T2;
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则平衡向逆反应方向移动,即Qc>K,所以
>1.25,则x<0.8,故答案为:0<x<0.8;
(2)电解池中阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应.根据题意可知:通入二氧化硫的电极为阳极,通入氧气的电极为阴极,阳极反应:SO2+2H2O-2e-=SO42-+4H+,阴极反应:O2+4H++4e-═2H2O,阴、阳电极反应合并得总反应为:2SO2+O2+2H2O=2H2SO4,
故答案为:2SO2+O2+2H2O=2H2SO4;SO2+2H2O-2e-=SO42-+4H+.
2SO2+O2?2SO3,
起始量(mol) 0 0 0.6
变化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
(1)①SO3的转化率为=
| 0.4 |
| 0.6 |
| c(SO 3) 2 |
| c(SO 2) 2c(O 2) |
| 0.2 2 |
| 0.4 2×0.2 |
②因为反应为放热反应,温度越低,平衡越向正反应方向移动,平衡常数越大,所以温度最低的为K最大的,即T2,故答案为:T2;
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则平衡向逆反应方向移动,即Qc>K,所以
| 0.2 2 |
| 0.22×x |
(2)电解池中阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应.根据题意可知:通入二氧化硫的电极为阳极,通入氧气的电极为阴极,阳极反应:SO2+2H2O-2e-=SO42-+4H+,阴极反应:O2+4H++4e-═2H2O,阴、阳电极反应合并得总反应为:2SO2+O2+2H2O=2H2SO4,
故答案为:2SO2+O2+2H2O=2H2SO4;SO2+2H2O-2e-=SO42-+4H+.
点评:本题考查了化学平衡的有关知识、电化学的有关知识,如利用浓度商判断化学反应进行的方向,外界条件对化学平衡的影响以及有关化学计算,试题较灵活,综合性强,难度较大.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
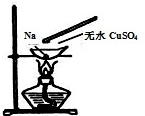 如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )
如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )| A、上述反应是置换反应 |
| B、上述反应说明钠比铜活泼 |
| C、上述反应证明钠可以从CuSO4溶液中置换出铜 |
| D、加热且无水条件下,Na可以与CuSO4反应并生成Cu |
向等浓度的NaOH和NaAlO2的混合溶液中,通入CO2,反应中表示各阶段反应的离子方程式中错误的是( )
| A、CO2+OH-→HCO3- |
| B、AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- |
| C、2AlO2-+CO2+3H2O↓→2Al(OH)3↓+CO32- |
| D、CO32-+CO2+2H2O→2HCO3- |
在无色溶液中,下列离子能大量共存的是( )
| A、Mg2+、SO42-、K+、Cl- |
| B、Na+、NH4+、NO3-、MnO4- |
| C、K+、Cu2+、Cl-、Br- |
| D、Ba2+、Na+、OH-、HCO3- |
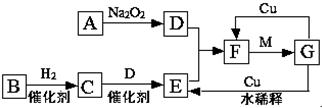 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体. 高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.
高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.