题目内容
 研究NO2、SO2、CO等大气污染气体的处理有重要意义.
研究NO2、SO2、CO等大气污染气体的处理有重要意义.(1)利用反应6NO2+8NH3
| 催化剂 |
| △ |
准状况下的体积是
(2)已知:2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ?mol-1
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ?mol-1
则NO2与SO2 反应生成SO3 和NO对应的热化学方程式为
一定条件下,将NO2与SO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
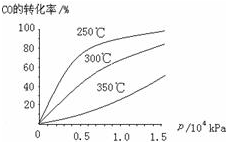
(3)①CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH (g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H
②CO一定条件下,还可以发生反应CO (g)+H2O (g)?CO2(g)+H2 (g),向2L密闭容器中通入2mol CO (g)、2mol H2O (g),2min后反应达到平衡时,测得CO的物质的量为1mol,用H2O (g)表示该反应速率为
考点:化学平衡的计算,热化学方程式,化学平衡的影响因素
专题:
分析:(1)利用氧化还原反应中电子转移计算,然后来计算标准状况下气体的体积;
(2)利用盖斯定律来计算反应热,利用化学平衡的特征“等”、“定”来判定化学平衡,利用三段法计算平衡时的浓度来计算化学平衡常数;
(3)①利用化学平衡的影响因素和图象来分析;
②根据反应的方程式H2O (g)+CO (g)?H2(g)+CO2 (g),分别计算起始、转化以及平衡时的物质的量,
利用V=
可计算出用CO表示达到平衡时该反应的平均速率;
利用K=
该反应的平衡常数;
利用平衡常数不变计算CO的转化率.
(2)利用盖斯定律来计算反应热,利用化学平衡的特征“等”、“定”来判定化学平衡,利用三段法计算平衡时的浓度来计算化学平衡常数;
(3)①利用化学平衡的影响因素和图象来分析;
②根据反应的方程式H2O (g)+CO (g)?H2(g)+CO2 (g),分别计算起始、转化以及平衡时的物质的量,
利用V=
| △c |
| △t |
利用K=
| C(CO 2)C(H 2) |
| C(CO)C(H 2O) |
利用平衡常数不变计算CO的转化率.
解答:
解:(1)当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为1.2÷4×22.4L=6.72L,
故答案为:6.72L.
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ?mol-1,故NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;
本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;
随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;
SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;
d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据;
故答案为:NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;b;
(3)①由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;
②H2O (g)+CO (g)?H2(g)+CO2 (g)
起始:2 2 0 0
变化:1 1 1 1
平衡:1 1 1 1
则用H2O (g)表示该反应速率为
=0.25mol/(L?min);
该反应的平衡常数k=
=1;
如果继续向该平衡体系中通入2.0mol的CO,设总反应CO为xmol,则
H2O (g)+CO (g)?H2(g)+CO2 (g)
起始:2 4 0 0
变化:x x x x
平衡:2-x 4-x x x
根据K=1=
,解得x=
,所以重新达到平衡时的CO总转化率为
×100%=33.3%
故答案为:0.25mol/(L?min);1;33.3%;
故答案为:6.72L.
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ?mol-1,故NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;
本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;
随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;
SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;
d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据;
故答案为:NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;b;
(3)①由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;
②H2O (g)+CO (g)?H2(g)+CO2 (g)
起始:2 2 0 0
变化:1 1 1 1
平衡:1 1 1 1
则用H2O (g)表示该反应速率为
| ||
| 2min |
该反应的平衡常数k=
| 1×1 |
| 1×1 |
如果继续向该平衡体系中通入2.0mol的CO,设总反应CO为xmol,则
H2O (g)+CO (g)?H2(g)+CO2 (g)
起始:2 4 0 0
变化:x x x x
平衡:2-x 4-x x x
根据K=1=
| x×x |
| (2-x)×(4-x) |
| 4 |
| 3 |
| ||
| 4 |
故答案为:0.25mol/(L?min);1;33.3%;
点评:该题将元素化合物与能量变化、化学平衡等知识柔和在一起进行考查,关键是化学平衡的计算,题目难度中等,注意根据物质的量的变化利用三段式法解答.

练习册系列答案
相关题目
下列纯净物不能和金属钠反应的是( )
| A、苯酚 | B、甘油 | C、酒精 | D、苯 |
现加热5.00g NaHCO3和Na2CO3的混合物,使NaHCO3完全分解,产生标况下CO2气体体积为224ml,则原混合物中Na2CO3的质量为( )
| A、3.32g |
| B、4.16g |
| C、4.58g |
| D、4.41g |
只需用一种试剂即可将酒精、苯酚溶液、苯、己烯四种无色液体区分开来,该试剂是( )
| A、FeCl3溶液 |
| B、溴水 |
| C、KMnO4溶液 |
| D、金属钠 |
2002年诺贝尔化学奖授予利用“质谱分析法”和“核磁共振技术”等对生物大分子进行研究并作出重大贡献的科学家.下列物质中属于生物大分子的是( )
| A、油脂 | B、葡萄糖 |
| C、蛋白质 | D、氨基酸 |
 直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.
直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.