题目内容
 直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.
直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理.(1)利用钠碱循环法可脱除烟气中的SO2.
①用化学方程式表示SO2形成硫酸型酸雨的反应:
②在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(2)处理氮氧化物的方法很多,以下列举几种常见方法.
①用过量NaOH溶液吸收NO2气体.所得溶液中除含有NaOH和NaNO2,还含有
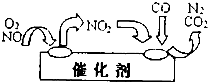
②为避免污染,常给汽车安装尾气净化装置.净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示.写出净化过程中的总化学反应方程式:
③用氨气可以将其转化为无害气体,发生的 反应为:6NOx+4xNH3=(3+2x)N2+6xH2O.某工厂排出的尾气中NOx的含量为0.56%(体积分数),若处理1×104L(标准状况)该尾气需42.5gNH3,则x=
考点:二氧化硫的污染及治理,氮的氧化物的性质及其对环境的影响
专题:
分析:(1)①二氧化硫与水反应生成亚硫酸,亚硫酸具有还原性被空气中的氧气氧化生成硫酸;
②二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
(2)①根据NaOH溶液吸收NO2气体发生反应有:3NO2+2NaOH═2NaNO3+NO+H2O,NO2+NO+2NaOH═2NaNO2+H2O据此判断;
②由图可知,NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,根据质量守恒定律配平方程式;
③先计算出NOx的体积,再求出NOx的物质的量,根据氨气的物质的质量求出其物质的量,最后根据物质的量之比等于化学计量数之比计算x的值.
②二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
(2)①根据NaOH溶液吸收NO2气体发生反应有:3NO2+2NaOH═2NaNO3+NO+H2O,NO2+NO+2NaOH═2NaNO2+H2O据此判断;
②由图可知,NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,根据质量守恒定律配平方程式;
③先计算出NOx的体积,再求出NOx的物质的量,根据氨气的物质的质量求出其物质的量,最后根据物质的量之比等于化学计量数之比计算x的值.
解答:
解:(1)①SO2、O2形成硫酸型酸雨的反应:SO2+H2O=H2SO3、2H2SO3+O2
2H2SO4,故答案为:SO2+H2O=H2SO3、2H2SO3+O2
2H2SO4;
②二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(2)①NaOH溶液吸收NO2气体发生反应有:3NO2+2NaOH═2NaNO3+NO+H2O,NO2+NO+2NaOH═2NaNO2+H2O,故所得的溶液中除了含有NaOH,NaNO2,还含有NaNO3,故答案为:NaNO3;
②NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,方程式为2NO+O2+4CO
4CO2+N2,故答案为:2NO+O2+4CO
4CO2+N2;
③1×104L(标准状况)该尾气中含有NOx的体积为:1×104L×0.56%=56L,标准状况下NOx的物质的量为
=2.5mol,42.5gNH3的物质的量为
═2.5mol,因物质的量之比等于化学计量数之比,则有:
=
,解得x=1.5,故答案为:1.5.
| ||
| ||
②二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(2)①NaOH溶液吸收NO2气体发生反应有:3NO2+2NaOH═2NaNO3+NO+H2O,NO2+NO+2NaOH═2NaNO2+H2O,故所得的溶液中除了含有NaOH,NaNO2,还含有NaNO3,故答案为:NaNO3;
②NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,方程式为2NO+O2+4CO
| ||
| ||
③1×104L(标准状况)该尾气中含有NOx的体积为:1×104L×0.56%=56L,标准状况下NOx的物质的量为
| 56L |
| 22.4L/mol |
| 42.5g |
| 17g/mol |
| 2.5mol |
| 2.5mol |
| 6 |
| 4x |
点评:本题考查学生对质量守恒定律的理解与应用,化学式的书写以及根据化学方程式进行计算的解题能力,综合性强,难度较大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
关于食物的酸碱性,下列说法正确的是( )
| A、食物溶于水后的溶液中pH<7,则为酸性食物 |
| B、由C、N、S、P等元素组成的蛋白质是酸性食物 |
| C、蔬菜、水果多含钾、钠、钙、镁等盐类及果酸,习惯称为酸性食物 |
| D、柠檬酸是酸性食物 |
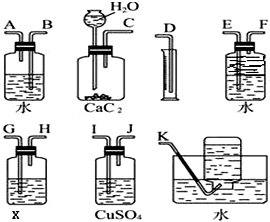 实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)
实验室用电石和水反应制备乙炔,其中含有杂质,为了净化和检验乙炔气体,并通过测定气体体积计算电石纯度,按下列要求填空(X为含溴3.2%的四氯化碳溶液150g)
 研究NO2、SO2、CO等大气污染气体的处理有重要意义.
研究NO2、SO2、CO等大气污染气体的处理有重要意义.