题目内容
下列实验操作、现象和解释都正确的是( )
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,物质的检验和鉴别的实验方案设计
专题:实验评价题
分析:A.能和盐酸反应产生二氧化碳气体的离子可以是碳酸根离子还可以是碳酸氢根离子;
B.Fe(OH)2易被氧化生成Fe(OH)3;
C.CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2;
D.向一种未知溶液中加入BaCl2溶液,有白色沉淀生成,沉淀可能是AgCl或BaSO4沉淀.
B.Fe(OH)2易被氧化生成Fe(OH)3;
C.CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2;
D.向一种未知溶液中加入BaCl2溶液,有白色沉淀生成,沉淀可能是AgCl或BaSO4沉淀.
解答:
解:A.某溶液加入足量盐酸,放出的气体能使澄清石灰水变浑浊,该气体是二氧化碳或是二氧化硫,该溶液中含有CO32-、SO32-、HCO3-中的至少一种离子,故A错误;
B.Fe(OH)2不稳定,易被氧化生成Fe(OH)3,故B正确;
C.CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,上层苯层呈紫红色,下层有白色沉淀生产,故C正确;
D.向一种未知溶液中加入BaCl2溶液,有白色沉淀生成,沉淀可能是AgCl或BaSO4沉淀,溶液中可能含有Cl-或SO42-离子,故D错误.
故选BC.
B.Fe(OH)2不稳定,易被氧化生成Fe(OH)3,故B正确;
C.CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,上层苯层呈紫红色,下层有白色沉淀生产,故C正确;
D.向一种未知溶液中加入BaCl2溶液,有白色沉淀生成,沉淀可能是AgCl或BaSO4沉淀,溶液中可能含有Cl-或SO42-离子,故D错误.
故选BC.
点评:本题考查离子反应的书写,明确发生的化学反应是解答本题的关键,注意发生的氧化还原反应为解答的难点,题目难度中等.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 如图,其电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )
如图,其电池反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则下列说法正确的是( )| A、充电时有CH3OH生成的电极为阳极 |
| B、放电时电解质溶液的pH逐渐增大 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1 mol CH3OH转移12mol电子 |
下列离子方程式书写正确的是( )
| A、铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | ||||
| B、二氧化硫与足量烧碱溶液反应:S02+20H-=S032-+H20 | ||||
| C、醋酸溶液与氢氧化钠溶液反应:H++OH-=H20 | ||||
D、浓盐酸与MnO2反应制Cl2:Mn02+2H++2C1-
|
X、Y、Z、W是前20号元素,原子序数依次增大.X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫.下列说法错误的是( )
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: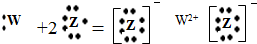 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |
下列气体所含原子数最多的是( )
| A、15g C2H6 |
| B、28g N2 |
| C、14g CO |
| D、48g O2 |
下面各装置图能达到实验目的是( )
A、 实验Ⅰ量取20.0mL的H2SO4待测液放入锥形瓶中 |
B、 实验Ⅱ用CaC2和饱和食盐水反应制取C2H2 |
C、 实验Ⅲ制取氨气 |
D、 实验Ⅳ褪色证明了乙烯可以与溴发生加成反应 |
下列说法正确的是( )
| A、实验室常用无水硫酸铜作气体干燥剂 |
| B、工业上常用电解AlCl3,制备金属Al |
| C、CO2溶于水能导电,故CO2是电解质 |
| D、NH4Cl溶液中离子浓度大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-) |