题目内容
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
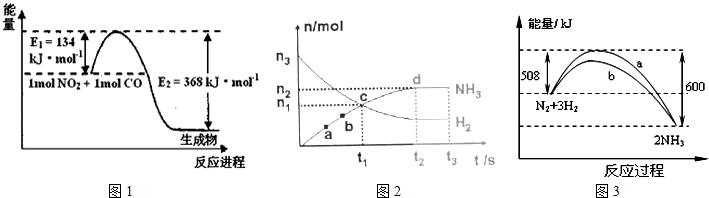
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 .
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题.
①试比较K1,K2的大小,K1 K2(填写“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是_ (填序号字母):
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正 v(N2)逆(填写“>”、“=”或“<”)
(3)一定条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图2所示.从开始到平衡时,反应的平均速率用H2的浓度变化表示为v(H2)= .
(4)在一定温度时,N2与H2反应过程中能量变化的曲线如图3所示,下列叙述正确的是
A.逆反应的活化能不小于92kJ/mol B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放热增多 D.加入催化剂可增大正反应速率,降低逆反应速率.

(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②下列各项能作为判断该反应达到化学平衡状态的依据是_
a.容器内N2.H2.NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正
(3)一定条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图2所示.从开始到平衡时,反应的平均速率用H2的浓度变化表示为v(H2)=
(4)在一定温度时,N2与H2反应过程中能量变化的曲线如图3所示,下列叙述正确的是
A.逆反应的活化能不小于92kJ/mol B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放热增多 D.加入催化剂可增大正反应速率,降低逆反应速率.
考点:热化学方程式,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(2)①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②根据平衡状态的判断依据判断;
③根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(3)分析图象变化和数值计算氨气的反应速率,结合v=
计算,依据反应速率之比等于化学方程式计量数之比计算氢气表示的反应速率;
(4)A、图象分析逆反应的活化能应为600KJ;
B、根据催化剂与能耗的关系分析;
C、根据催化剂只能降低反应的活化能,不改变化学平衡分析;
D、依据催化剂的概念和影响速率的实质分析判断.
(2)①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②根据平衡状态的判断依据判断;
③根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(3)分析图象变化和数值计算氨气的反应速率,结合v=
| △c |
| △t |
(4)A、图象分析逆反应的活化能应为600KJ;
B、根据催化剂与能耗的关系分析;
C、根据催化剂只能降低反应的活化能,不改变化学平衡分析;
D、依据催化剂的概念和影响速率的实质分析判断.
解答:
解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:K1>K2;
②a、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故a错误;
b、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆)是平衡状态,故b错误;
c、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故答案为:c;
③容器的体积为0.5L,NH3和N2.H2的物质的量浓度分别为:2mol/L、4mol/L、6mol/L,400℃时,浓度商Qc=
=
<K,说明反应正向进行,因此有v(N2)正>v(N2)逆;
故答案为:>;
(3)开始到平衡时反应的平均速率v(NH3)=
=
mol/(L.s),则V(H2)=
V(NH3)=
mol/L?s,故答案为:
mol/L?s;
(4)A、图象分析可知逆反应的活化能应为600KJ,不小于92kJ/mol,故A正确;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故B正确;
C、加入催化剂改变反应速率,不改变化学平衡,反应的热效应不变,故C错误;
D、加入催化剂是同等程度的增大或减小正逆反应速率,故D错误;
故答案为:AB.
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:K1>K2;
②a、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故a错误;
b、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆)是平衡状态,故b错误;
c、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故答案为:c;
③容器的体积为0.5L,NH3和N2.H2的物质的量浓度分别为:2mol/L、4mol/L、6mol/L,400℃时,浓度商Qc=
| 22 |
| 4×63 |
| 1 |
| 216 |
故答案为:>;
(3)开始到平衡时反应的平均速率v(NH3)=
| △c |
| △t |
| ||
| t2 |
| 3 |
| 2 |
| 3n2 |
| 2Vt2 |
| 3n2 |
| 2Vt2 |
(4)A、图象分析可知逆反应的活化能应为600KJ,不小于92kJ/mol,故A正确;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故B正确;
C、加入催化剂改变反应速率,不改变化学平衡,反应的热效应不变,故C错误;
D、加入催化剂是同等程度的增大或减小正逆反应速率,故D错误;
故答案为:AB.
点评:本题考查化学平衡常数及影响因素、意义,反应速率计算等,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.

练习册系列答案
相关题目
25℃时,Fe(OH)3的Ksp=4×10-38,若使某溶液中Fe3+完全沉淀所需pH最接近( )
| A、3 | B、7 | C、9 | D、11 |
下列如图装置能达到实验目的是( )


| A、实验室用装置甲制氨气 |
| B、装置乙可用于收集O2、CO2、NO2等气体 |
| C、装置丙可用于分离沸点相差较大的互溶液体混合物 |
| D、装置丁中上层为苯,下层为水,可用于吸收氨气,并能防止倒吸 |
设NA为阿伏伽德罗常数值,下列说法正确的是( )
| A、5.6gFe与2.24L氯气充分反应,转移电子数为2NA |
| B、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| C、1 mol?L-1的NaCl溶液中,所含Na+ 数目为NA |
| D、标准状况下,11.2L SO3中含1.5NA个氧原子 |



