题目内容
已知A、B、C、D、E是含有同一种元素,且常温下A、B、E是气体,它们之间能发生如下反应(部分产物已略去):

(1)写出它们的化学式:A 、B 、C 、E ;
(2)反应A和F的反应中氧化剂和还原剂的质量比为 .
(3)A和E能够反应,且产物都为空气的组成成分,请写出相关方程式 .

(1)写出它们的化学式:A
(2)反应A和F的反应中氧化剂和还原剂的质量比为
(3)A和E能够反应,且产物都为空气的组成成分,请写出相关方程式
考点:无机物的推断
专题:
分析:D溶液与NaOH溶液反应生成气体E,则D中含有铵根离子,E为NH3,NH3与氧气反应生成NO和H2O,B为气体,则B为NO、F为H2O;A为气体,与水反应生成NO和C溶液,则A为NO2、C为HNO3,HNO3与氨气反应生成硝酸铵,则D为硝酸铵,据此进行解答.
解答:
解:(1)D溶液与NaOH溶液反应生成气体E,则D中含有铵根离子,E为NH3,NH3与氧气反应生成NO和H2O,B为气体,则B为NO、F为H2O;A为气体,与水反应生成NO和C溶液,则A为NO2、C为HNO3,HNO3与氨气反应生成硝酸铵,则D为硝酸铵,
根据分析可知:A为NO2、B为NO、C为HNO3、E为NH3,
故答案为:NO2;NO;HNO3;NH3;
(2)A为NO2、F为H2O,二者反应的方程式为:3NO2+H2O=NO+2HNO3,反应中3mol二氧化氮中,做氧化剂的有1mol,做还原剂的为2mol,所以氧化剂和还原剂的质量比等于二者的物质的量之比:1mol:2mol=1:2,
故答案为:1:2;
(3)A为NO2、E为NH3,产物都为空气的组成成分,根据质量守恒定律可知,反应产物为氮气和水,二氧化氮中N元素的化合价为+4价,反应后变为0价,化合价变化为:(4-0)=4;氨气中N元素的化合价为-3价,反应后变为0价,化合价变化为3,则化合价变化的最小公倍数为12,二氧化氮的系数为3,氨气的系数为4,由于氮气为双原子分子,则二氧化氮的系数为6、氨气的系数为8,然后根据质量守恒定律配平,配平后反应的化学方程式为:6NO2+8NH3=7N2+12H2O,
故答案为:6NO2+8NH3=7N2+12H2O.
根据分析可知:A为NO2、B为NO、C为HNO3、E为NH3,
故答案为:NO2;NO;HNO3;NH3;
(2)A为NO2、F为H2O,二者反应的方程式为:3NO2+H2O=NO+2HNO3,反应中3mol二氧化氮中,做氧化剂的有1mol,做还原剂的为2mol,所以氧化剂和还原剂的质量比等于二者的物质的量之比:1mol:2mol=1:2,
故答案为:1:2;
(3)A为NO2、E为NH3,产物都为空气的组成成分,根据质量守恒定律可知,反应产物为氮气和水,二氧化氮中N元素的化合价为+4价,反应后变为0价,化合价变化为:(4-0)=4;氨气中N元素的化合价为-3价,反应后变为0价,化合价变化为3,则化合价变化的最小公倍数为12,二氧化氮的系数为3,氨气的系数为4,由于氮气为双原子分子,则二氧化氮的系数为6、氨气的系数为8,然后根据质量守恒定律配平,配平后反应的化学方程式为:6NO2+8NH3=7N2+12H2O,
故答案为:6NO2+8NH3=7N2+12H2O.
点评:本题考查氮及其化合物转化框图题的有关判断,为高考中的常见题型,属于基础性试题的考查,题目难度中等,试题侧重对学生基础知识的巩固个训练,解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等.

练习册系列答案
相关题目
进行化学实验必须注意安全,下列说法不正确的是( )
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、从煤油中取用金属钠必需用镊子,不能用手触摸 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO(g)+H2O(g)
CO2(g)+H2(g);当反应达到平衡时,CO的体积分数为x.若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
| ||
| 高温 |
| A、0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
| B、1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
| C、0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 |
| D、0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
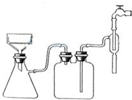 茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)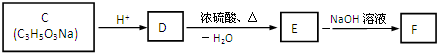
 金属是一种重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中的铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.
金属是一种重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中的铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.