题目内容
12.有机物A、B、C、D、E有如下转化关系.回答下列问题: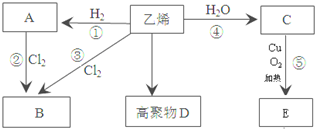
(1)乙烯的电子式为
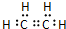 ,C中所含官能团的名称羟基;
,C中所含官能团的名称羟基;(2)写出下列反应的化学方程式和有机反应类型:
④CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.
⑤2CH3CH2OH+O2$→_{△}^{铜}$2CH3CH2O+2H2O,反应类型:氧化反应.
(3)反应②和反应③都可以用来制备物质B,反应②的条件为光照.若要制取物质B,最好采用反应③(填②或③),原因是③产物纯净.
(4)若用惰性材料做电极,以稀硫酸溶液为电解质溶液,两电极分别通入O2与甲烷,制成燃料电池,回答下列问题:
①已知电池的总反应即为甲烷的燃烧反应,则电池的总反应方程式为CH4+2O2$\stackrel{点燃}{→}$2H2O+CO2正极电极反应式为:O2+4e-+2H2O═4OH-
②消耗标准状况下的O25.6L时,有1mol电子发生转移.
③溶液中H+的移动方向是b
a由正极区向负极区移动 b由负极区向正极区移动
c从正极经外电路向负极移动 d从负极经外电路向正极移动.
分析 乙烯与水发生加成反应生成C为CH3CH2OH,乙醇氧化得E为CH3COOH,乙烯与氢气发生加成反应生成A为CH3CH3,乙烯与氯气发生加成反应生成B为ClCH2CH2Cl,乙烷与氯气发生取代反应可以得到ClCH2CH2Cl,乙烯发生加聚反应生成高聚物D为 ,据此解答.
,据此解答.
解答 解:乙烯与水发生加成反应生成C为CH3CH2OH,乙醇氧化得E为CH3COOH,乙烯与氢气发生加成反应生成A为CH3CH3,乙烯与氯气发生加成反应生成B为ClCH2CH2Cl,乙烷与氯气发生取代反应可以得到ClCH2CH2Cl,乙烯发生加聚反应生成高聚物D为 ,
,
(1)乙烯的电子式为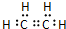 ,C为CH3CH2OH,C中所含官能团的名称是羟基,
,C为CH3CH2OH,C中所含官能团的名称是羟基,
故答案为: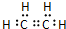 ;羟基;
;羟基;
(2)反应④的反应方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,属于加成反应,
反应⑤的反应方程式为:2CH3CH2OH+O2$→_{△}^{铜}$2CH3CH2O+2H2O,属于氧化反应;
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,加成反应;2CH3CH2OH+O2$→_{△}^{铜}$2CH3CH2O+2H2O,氧化反应;
(3)反应②为乙烷与氯气的取代,反应条件为光照,反应③为乙烯与氯气的加成反应,若要制取物质ClCH2CH2Cl,最好采用反应③,因为反应②产物有多种,而反应③产物纯净,
故答案为:光照;③;③产物纯净;
(4)①以稀硫酸溶液为电解质溶液,甲烷燃料电池的总反应方程式为CH4+2O2$\stackrel{点燃}{→}$2H2O+CO2,正极电极反应式为:O2+4e-+2H2O═4OH-,
故答案为:CH4+2O2$\stackrel{点燃}{→}$2H2O+CO2;O2+4e-+2H2O═4OH-;
②5.6L O2的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,转移电子的物质的量为:0.25mol×4=1mol,故答案为:1;
③原电池内部阳离子移向正极,阴离子移向负极,故氢离子从负极区流向正极区,故答案为:b.
点评 本本题考查了有机物的推断,涉及酯、醇、醛、羧酸之间的转化,解题的关键是熟练掌握乙烯的性质,答题时注意烯烃、卤代烃、醇、醛、羧酸、酯之间的转化关系及反应条件,灵活运用知识解答问题.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 食醋 | B. | 酒精 | C. | 食盐 | D. | 葡萄糖 |
| A. | H3PO2溶于水的电离方程式为:H3PO2?3H++PO23- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2-4e-+2H2O=O2↑+4H+ |
 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:A.用蒸馏水洗干净滴定管 B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次 E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)EABCFGD
(2)操作F中应该选择图中乙_滴定管(填标号).
(3)滴定时边滴边摇动锥 形瓶,眼睛应观察B
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化滴定终点溶液颜色的变化是无色变浅红色且半分钟内不褪色
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.03 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.60 | |
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为0.1000mol/L.
(6)如果准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?是(填“是”或“否”).
| A. | c(H+)<c(OH-)<c(CH3COO-)<c(Na+) | B. | c(H+)<c(OH-)<c(Na+)<c(CH3COO-) | ||
| C. | c(H+)<c(CH3COO-)<c(OH-)<c(Na+) | D. | c(OH-)<c(CH3COO-)<c(H+)<c(Na+) |
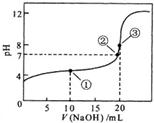 常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )
常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| A. | 定性检验SO32-,可用HNO3酸化的BaCl2溶液 | |
| B. | 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 | |
| C. | 检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 | |
| D. | 检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液 |
| A. | 具有相同数目的原子 | B. | 都占22.4 L | ||
| C. | 具有相同数目的分子 | D. | 具有相同的质量 |