题目内容
3.次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性.下列有关说法正确的是( )| A. | H3PO2溶于水的电离方程式为:H3PO2?3H++PO23- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2-4e-+2H2O=O2↑+4H+ |
分析 A.一元弱酸在溶液中部分电离出一个氢离子;
B.一元弱酸与NaOH按照物质的量1:1反应;
C.H3PO2具有还原性,能被高锰酸钾氧化;
D.H3PO2具有较强的还原性,电解时,阳极上H2PO2-失电子.
解答 解:A.一元弱酸在溶液中部分电离出一个氢离子,则H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2-,故A错误;
B.一元弱酸与NaOH按照物质的量1:1反应,所以H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O,故B错误;
C.H3PO2具有还原性,能被高锰酸钾氧化,则将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4,故C错误;
D.H3PO2具有较强的还原性,电解时,阳极上H2PO2-失电子,所以用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2--4e-+2H2O═H3PO4+3H+,故D正确;
故选D.
点评 本题考查氧化还原反应、电离方程式的书写、电解原理的应用等知识点,明确物质的性质是解本题关键,利用电极方程式的书写方法、电离方程式书写规则、盐类水解原理解答即可,题目难度中等.

练习册系列答案
相关题目
13.下列有机物的命名正确的是( )
| A. |  :2-羟基丁烷 :2-羟基丁烷 | B. |  :3-乙基-1-丁烯 :3-乙基-1-丁烯 | ||
| C. |  :1,3-二溴丙烷 :1,3-二溴丙烷 | D. |  :2,2,3-三甲基戊烷 :2,2,3-三甲基戊烷 |
14.SO2溶于水后所得的溶液的性质是 ( )
| A. | 有氧化性、无还原性、无酸性 | B. | 无氧化性、有还原性、无酸性 | ||
| C. | 有氧化性、有还原性、有酸性 | D. | 有氧化性、无还原性、有酸性 |
8.下列措施不能加快燃煤燃烧速率的是( )
| A. | 加入生石灰 | B. | 粉碎成煤粉 | ||
| C. | 多鼓入空气 | D. | 燃烧时掺入少量水 |
15.化学是以实验为基础的科学,关于下列各实验装置的叙述中,正确的是:( )


| A. | 仪器①可用于乙醇与水分离提纯 | |
| B. | 仪器②可用于称取5.85 g氯化钠固体 | |
| C. | 装置③的烧瓶中应加沸石,以防暴沸 | |
| D. | 装置④从箭头方向进气,用排空气法可收集H2 |
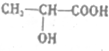 .
.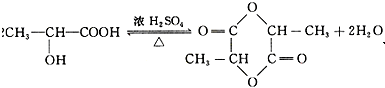 .
. .
.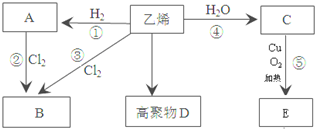
 ,C中所含官能团的名称羟基;
,C中所含官能团的名称羟基;
 .
.