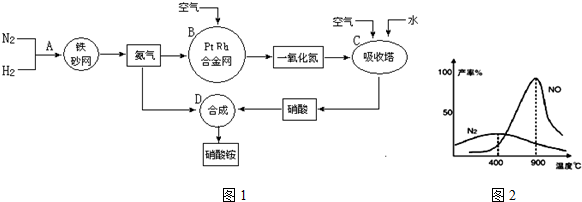
题目内容
17.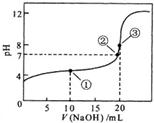 常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )
常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
分析 A.点①所示溶液中,为等浓度的醋酸和醋酸钠溶液;
B.点②所示溶液中,根据电荷守恒并结合溶液显中性来分析;
C.点③所示溶液,恰好反应生成醋酸钠,水解显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
D.在滴定中当加入碱比较少时,可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)的情况.
解答 解:A.点①溶液中,加入10mL氢氧化钠溶液,此时溶质为等浓度的醋酸和醋酸钠溶液,根据物料守恒可知,2c(Na+)=c(CH3COOH)+c(CH3COO-),故A正确;
B.点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),故B正确;
C.点③,加入20mL氢氧化钠溶液,两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,溶液显示碱性,且醋酸根离子水解程度较小,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,溶液中可能存在:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选C.
点评 本题考查酸碱混合溶液中离子浓度的关系,题目难度中等,明确混合后溶液中的溶质是解答的关键,注意电荷守恒、物料守恒及盐的水解在比较离子浓度大小中的应用方法.

练习册系列答案
相关题目
7.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1的溶液中:NH+4、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- |
8.下列措施不能加快燃煤燃烧速率的是( )
| A. | 加入生石灰 | B. | 粉碎成煤粉 | ||
| C. | 多鼓入空气 | D. | 燃烧时掺入少量水 |
5.HEMA是制备隐形眼镜的材料,其名称是聚甲基丙烯酸羟乙酯,则合成它的单体为( )
| A. | CH3-CH=CH-COOH, | B. |  ,CH3CH2OH ,CH3CH2OH | ||
| C. |  ,HOCH2CH2OH ,HOCH2CH2OH | D. | CH3-CH=CH-COOH,CH3CH2OH |
2.将pH=6的盐酸与pH=4的盐酸等体积混合后,溶液中c(OH-)最接近于( )
| A. | 0.5×(10-8+10-10)mol•L-1 | B. | (10-8+10-10)mol•L-1 | ||
| C. | (1×10-5-5×10-14)mol•L-1 | D. | 2×10-10mol•L-1 |
9.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 铁锈溶于过量醋酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
6.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入硝酸酸化的硝酸钡溶液既无沉淀也无气体生成,再加硝酸银溶液立即出现白色沉淀,一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ |
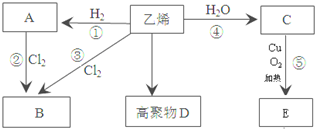
 ,C中所含官能团的名称羟基;
,C中所含官能团的名称羟基;