题目内容
下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A、常温下,2.7 g 铝与足量的盐酸反应,得到的电子数为0.3NA |
| B、标准状况下,44.8LSO2与22.4LO2在催化剂作用下反应,一定生成2NA个SO3 |
| C、常温常压下,16g臭氧含有的氧原子数目为NA |
| D、通常状况下,11.2LCO2含有的分子数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.铝为活泼金属,在反应中失去电子,不会得到电子;
B.二氧化硫与氧气的反应为可逆反应,反应物不可能完全转化成生成物;
C.臭氧中只含有氧原子,16g臭氧分子中含有16g氧原子,含有氧原子的物质的量为1mol;
D.通常状况下,不是标况下,不能使用标况下的气体摩尔体积计算其物质的量.
B.二氧化硫与氧气的反应为可逆反应,反应物不可能完全转化成生成物;
C.臭氧中只含有氧原子,16g臭氧分子中含有16g氧原子,含有氧原子的物质的量为1mol;
D.通常状况下,不是标况下,不能使用标况下的气体摩尔体积计算其物质的量.
解答:
解:A.2.7g铝的物质的量为0.1mol,0.1mol铝完全反应失去0.3mol电子,失去的电子数为0.3NA,不是得到电子,故A错误;
B.标况下44.8LSO2与22.4LO2的物质的量分别为2mol、1mol,由于二氧化硫转化成三氧化硫的反应为可逆反应,则反应生成的三氧化硫小于2mol,故B错误;
C.16g臭氧分子中含有16g氧原子,含有1mol氧原子,含有的氧原子数目为NA,故C正确;
D.不是标况下,不能使用标况下的气体摩尔体积计算11.2L二氧化碳的物质的量,故D错误;
故选C.
B.标况下44.8LSO2与22.4LO2的物质的量分别为2mol、1mol,由于二氧化硫转化成三氧化硫的反应为可逆反应,则反应生成的三氧化硫小于2mol,故B错误;
C.16g臭氧分子中含有16g氧原子,含有1mol氧原子,含有的氧原子数目为NA,故C正确;
D.不是标况下,不能使用标况下的气体摩尔体积计算11.2L二氧化碳的物质的量,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项A为易错点,注意铝在反应中是失去电子,不是得到电子.

练习册系列答案
相关题目
分别往含有下列离子的溶液中通入氯气,离子浓度不会减少的是( )
| A、H+ |
| B、HC03- |
| C、OH- |
| D、Ag+ |
下列物质间的变化,不能通过一步化学反应实现的是( )
| A、Fe→Fe3O4 |
| B、Fe3O4→Fe |
| C、Fe→FeC12 |
| D、Fe (OH)3→Fe (OH)2 |
设NO+CO2?2CO(正反应吸热)反应速率为v1;N2+3H2?2NH3(正反应放热)反应速率为v2.对于前述反应,当温度升高时,v1和v2变化情况为( )
| A、同时增大 |
| B、同时减小 |
| C、v1减少,v2增大 |
| D、v1增大,v2减小 |
在容量瓶上无须标记的是( )
| A、刻度线 | B、温度 | C、浓度 | D、规格 |
aAn+、bB(n+1)+、cCn-、dD(n+1)-的电子层结构相同.关于A、B、C、D四种元素叙述正确的是( )
| A、一定都是短周期元素 |
| B、单质的还原性:B>A |
| C、气态氢化物的热稳定性:D>C |
| D、原子序数:B>A>C>D |
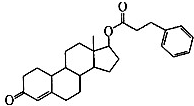 苯丙酸诺龙是一种兴奋剂,结构简式为:
苯丙酸诺龙是一种兴奋剂,结构简式为: