题目内容
11.在某表面被氧化的钢铁样品a g中,加入稀硫酸150 mL,放出标准状况下的H2 b L,且样品完全溶解.向反应后的溶液里滴加KSCN溶液无明显现象.为使样品中的铁元素完全沉淀下来,恰好消耗3mol•L-1的NaOH溶液200mL,则原稀硫酸的物质的量浓度是( )| A. | 2 mol•L-1 | B. | 3.36 mol•L-1 | ||
| C. | 1.5 mol•L-1 | D. | 缺少数据,无法计算 |
分析 样品完全溶解后,滴入KSCN无明显现象,则生成物均为FeSO4,加入NaOH溶液,先中和过量的硫酸,生成Na2SO4,再与FeSO4反应生成Fe(OH)2和Na2SO4,即充分反应后溶质只有一种Na2SO4,即NaOH的物质的量是H2SO4物质的量的2倍,由此分析解答.
解答 解:样品完全溶解后,滴入KSCN无明显现象,则生成物均为FeSO4,加入NaOH溶液,先中和过量的硫酸,生成Na2SO4,再与FeSO4反应生成Fe(OH)2和Na2SO4,即充分反应后溶质只有一种Na2SO4,即NaOH的物质的量是H2SO4物质的量的2倍.故有:c(H2SO4)×0.15 L×2=3 mol•L-1×0.2 L,所以c(H2SO4)=2 mol•L-1,故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.下列离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将Al投入到烧碱溶液中:2Al+2OH-═AlO2-+2H2O | |
| C. | 将Al(OH)3投入到烧碱溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入适量KOH溶液:HCO3-+OH-═CO2↑+H2O |
2.将一定质量的镁铜合金加入到100mL某浓度HNO3溶液中,两者恰好反应,假设反应的还原产物只有NO气体,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A. | 加入合金的质量不可能为6.6g | |
| B. | 参加反应的硝酸的物质的量浓度为1mol/L | |
| C. | 生成沉淀完全时消耗NaOH溶液的体积为100 mL | |
| D. | 生成NO气体体积为2.24 L |
19.下列措施能使煤炭燃烧最充分,提高热能利用率的是( )
| A. | 向燃烧正旺的炉火上洒一些水 | B. | 把煤炭做成大煤球 | ||
| C. | 把煤中掺一些黄泥做成蜂窝煤 | D. | 把煤粉碎,在煤粉燃烧器中燃烧 |
16.表中,第Ⅰ栏和第Ⅱ栏的化学反应都可以用第Ⅲ栏的离子方程式表示的是( )
| 编号 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | H2SO4溶液中滴加Ba(OH)2至恰好沉淀完全 | 在NaHSO4溶液中滴加Ba(OH)2至中性 | H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B | 氢氧化钠溶液中通入过量CO2 | 氢氧化钙溶液中滴入过量CO2 | OH-+CO2═HCO3- |
| C | 向碳酸氢铵溶液中加过量澄清石灰水 | 向碳酸氢钠溶液中加过量澄清石灰水 | HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D | FeBr2溶液和少量Cl2反应 | FeI2溶液和少量Cl2反应 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
20.比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推导不合理的是( )
| 序号 | 化学反应事实 | 影响化学反应因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气发生反应,而在高温时能与氧气反应 | 反应温度 |
| C | 水在通电的条件才能分解,双氧水只要加入二氧化锰就迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,纳米铜粉在空气中较易燃烧 | 反应物的接触面积 |
| A. | A | B. | B | C. | C | D. | D |
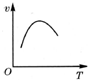
1.如图是关于反应aA2(g)+bB2(g)?cC(g)△H<0 的平衡移动图象,影响平衡移动的原因可能是( )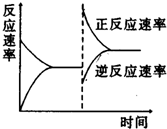

| A. | 升高温度,同时加压 | |
| B. | 降低温度,同时减压 | |
| C. | 增大反应物浓度,同时减小生成物浓度 | |
| D. | 增大反应物浓度,同时升高温度 |
 .
.