题目内容
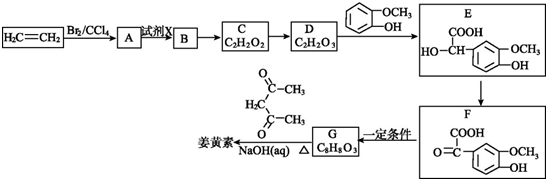
18.A、B、C、D、E、F、G均为芳香族化合物,有如下转化关系:
(1)有机物C的分子式为C8H10O2,核磁共振氢谱显示3组峰,C不能与NaOH反应,写出C的结构简式
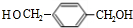 .上述反应中属于取代反应的是①②(填数字序号).
.上述反应中属于取代反应的是①②(填数字序号).(2)写出反应②、③的化学方程式:
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaCl;
+2NaCl; +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$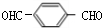 +2H2O.
+2H2O.(3)1 mol D与足量的银氨溶液完全反应生成E,E是合成纤维涤纶的一种单体,另一种单体是C,写出合成涤纶的化学方程式
 .
.(4)1 mol E、F(F的式量小于E)完全燃烧,消耗O2的量相等,且1 mol F能和1 mol NaOH完全反应,写出F的结构简式
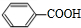 .
.(5)G的分子式为C8H8O4,且知苯环上的一氯取代物只有两种,G不与NaHCO3反应,能与Na和NaOH反应,等质量的G消耗Na和NaOH的物质的量之比为2:3,则符合上述条件G的结构简式为
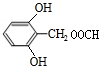 或
或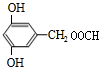 (写出一种).
(写出一种).
分析 A、B、C、D、E、F、G均为芳香族化合物,有机物C的分子式为C8H10O2,结合转化关系可知C中含有羟基,C不能与NaOH反应,含有醇羟基,且羟基可以被氧化,其核磁共振氢谱显示3组峰,故C为 ,逆推可知B为
,逆推可知B为 ,A为
,A为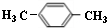 ,顺推可知D为
,顺推可知D为 ,E为
,E为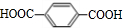 ,
,
(4)中1mol E、F(F的式量小于E)完全燃烧,消耗O2的量相等,E分子式改写C6H6.2CO2,且1mol F能和1mol NaOH完全反应,则F分子式可以为C6H6.CO2形式,故F的结构简式为 .
.
(5)中G的分子式为C8H8O4,G不与NaHCO3反应,不含-COOH,能与Na和NaOH反应,含有酚羟基,等质量的G消耗Na和NaOH的物质的量之比为2:3,则G分子中含有2个酚羟基、1个酯基(羧酸与醇形成的酯基),故侧链为2个-OH、1个-CH2OOCH,且知苯环上的一氯取代物只有两种,可以是三个侧链相邻,且-CH2OOCH处于2个-OH之间,或三个侧链为间位位置.
解答 解:A、B、C、D、E、F、G均为芳香族化合物,有机物C的分子式为C8H10O2,结合转化关系可知C中含有羟基,C不能与NaOH反应,含有醇羟基,且羟基可以被氧化,其核磁共振氢谱显示3组峰,故C为 ,逆推可知B为
,逆推可知B为 ,A为
,A为 ,顺推可知D为
,顺推可知D为 ,E为
,E为 ,
,
(1)由上述分析可知,C的结构简式为 ,上述反应中,反应①②属于取代反应,③④属于氧化反应,故答案为:
,上述反应中,反应①②属于取代反应,③④属于氧化反应,故答案为: ;①②;
;①②;
(2)反应②的化学方程式为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaCl,
+2NaCl,
反应③的化学方程式为: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O,
+2H2O,
故答案为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaCl;
+2NaCl; +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;
+2H2O;
(3)E( )是合成纤维涤纶的一种单体,另一种单体是C(
)是合成纤维涤纶的一种单体,另一种单体是C( ),二者合成合成涤纶的化学方程式为:
),二者合成合成涤纶的化学方程式为: ,
,
故答案为: ;
;
(4)中1mol E、F(F的式量小于E)完全燃烧,消耗O2的量相等,E分子式改写C6H6.2CO2,且1mol F能和1mol NaOH完全反应,则F分子式可以为C6H6.CO2形式,故F的结构简式为 ,故答案为:
,故答案为: ;
;
(5)中G的分子式为C8H8O4,G不与NaHCO3反应,不含-COOH,能与Na和NaOH反应,含有酚羟基,等质量的G消耗Na和NaOH的物质的量之比为2:3,则G分子中含有2个酚羟基、1个酯基(羧酸与醇形成的酯基),故侧链为2个-OH、1个-CH2OOCH,且知苯环上的一氯取代物只有两种,可以是三个侧链相邻,且-CH2OOCH处于2个-OH之间,或三个侧链为间位位置,符合条件的G的结构为 或
或 ,故答案为:
,故答案为: 或
或 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据流程图中反应条件结合题给信息进行推断,正确推断各物质结构简式是解本题关键,难点是限制性条件结构简式推断,题目难度中等.


(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除杂、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol•L-1 HCl、1mol•L-1 H2SO4、0.1mol•L-1 NaOH、0.1mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,:加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
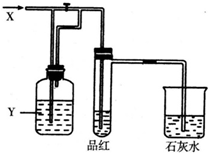 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )| ① | ② | ③ | ④ | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和的NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
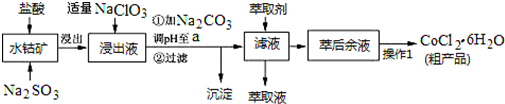
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
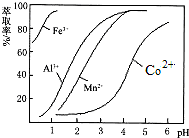
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
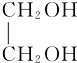 +O2$→_{△}^{Cu}$OHC-CHO+2H2O.
+O2$→_{△}^{Cu}$OHC-CHO+2H2O.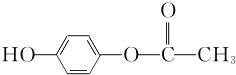 .
. .
. .
. 理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.