题目内容
18.某研究小组向2L密闭容器中加入过量的活性炭和0.2mol NO,恒温(T1℃)下发生反应:C(s)+2NO(g)?N2(g)+CO2(g)Q kJ/mol(Q>0).30min后达到平衡,测得NO浓度为0.04mol/L.回答下列问题:(1)该反应的平衡常数表达式K=$\frac{{[{N_2}]•[CO]}}{{{{[NO]}^2}}}$;T1℃达到平衡时,N2的平均反应速率=0.001mol/(L•min).
(2)30min后,若改变某一条件提高NO的转化率,则可以改变的条件是降温、除去二氧化碳.
(3)若开始时密闭容器的体积为1L,其他条件不变,达到平衡后,与原平衡相比,下列说法正确的是ab.
a.NO的转化率不变
b.N2的浓度是原来的2倍
c.反应放出的热量为0.1Q
d.达到平衡的时间是原来的一半.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、醇液体不需要写出;
根据v=$\frac{△c}{△t}$计算v(NO),再 利用速率之比等于化学计量数之比计算v(N2);
(2)提高NO的转化率,改变条件使平衡向正反应移动,注意不能增大NO的浓度;
(3)若开始时密闭容器的体积为1L,其它条件不变,等效为增大压强,该反应前后气体的物质的量不变,平衡不移动,与原平衡为等效平衡,据此结合选项判断.
解答 解:(1)可逆反应C(s)+2NO(g)?N2(g)+CO2(g)平衡常数k=$\frac{{[{N_2}]•[CO]}}{{{{[NO]}^2}}}$.30min后达到平衡,测得NO浓度为0.04mol/L,则△c(NO)=$\frac{0.2mol}{2L}$=0.1mol/L-0.04mol/L=0.06mol/L,故v(NO)=$\frac{0.06mol/L}{30min}$=0.002mol/(L•min),速率之比等于化学计量数之比,故v(N2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×0.002mol/(L•min)=0.001 mol/(L•min),
故答案为:$\frac{{[{N_2}]•[CO]}}{{{{[NO]}^2}}}$;0.001 mol/(L•min);
(2)该反应正反应是放热反应,降低温度可以使平衡向正反应移动,提高NO的转化率,除去二氧化碳以使平衡向正反应移动,提高NO的转化率,
故答案为:降温、除去二氧化碳;
(3)若开始时密闭容器的体积为1L,其它条件不变,等效为增大压强,该反应前后气体的物质的量不变,平衡不移动,与原平衡为等效平衡,
a.平衡不移动,与原平衡为等效平衡,NO的转化率不变,故a正确;
b.平衡时N2的物质的量不变,体积缩小一倍,故浓度是原来的2倍,故b正确;
c.NO的转化率不变,参加反应的NO的物质的量与原平衡相同为0.2mol-0.04mol/L×2L=0.12mol,故反应放出的热量为$\frac{0.12mol}{2mol}$×Q=0.06Q,故c错误;
d.压强增大一倍,反应速率加快,但不一定是原平衡的2倍,故达到平衡的时间不一定原来的一半,故d错误;
故答案为:ab.
点评 本题考查化学平衡问题,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及化学平衡常数、反应速率计算、化学平衡计算与影响因素等,难度中等,(3)中注意理解等效平衡规律.


该反应后的混合物含有:3,5-二甲氧基苯酚、甲醇、水和HCl.
已知:甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质如下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.795 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚、微溶于水 |
(1)利用与其它物质 差异较大的特点,可先用蒸馏法分离出甲醇,蒸馏操作时使用的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶.
(2)①蒸馏出甲醇后,加入乙醚进行萃取、分液操作,有机层在分液漏斗的上层.
②双项选择:选用乙醚这种试剂的主要原因是BC.
A.乙醚易挥发
B.3,5-二甲氧基苯酚在乙醚中溶解度大于在水中的溶解度
C.乙醚难溶于水
D.3,5-二甲氧基苯酚熔点较低
(3)经上述步骤分离得到的有机层再用饱和NaHCO3溶液洗涤,其目的是除去HCl.
(4)洗涤完成后,加入无水CaCl2干燥,过滤除去干燥剂,蒸馏除去乙醚,得到固体产物,为进一步提纯固体产物还要进行重结晶操作.
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| A. | K、Na、Al | B. | O、Cl、H | C. | Si、P、H | D. | O、S、Cl |
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
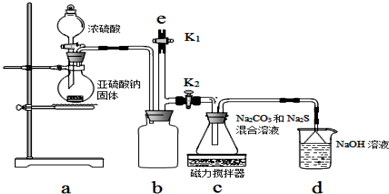
 为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.