题目内容
4.下列说法正确的是( )| A. | 反应2CO(g)→2C(s)+O2(g);△H>0不能自发进行,加入适当的催化剂可以自发 | |
| B. | 粗铜电解精炼时,阳极减少的质量与阴极增加的质量一定相同 | |
| C. | 体积均为10mL pH均为2的盐酸与醋酸,分别加入0.1g Zn,最终醋酸产生的H2多 | |
| D. | 一定条件下反应2NO2(g)?N2O4(g)达到平衡时,v(NO2)逆=2v(N2O4)正 |
分析 A.依据自发进行的判断依据△H-△ST分析,催化剂对△H无影响;
B.电解精炼时阳极溶解的金属与阴极析出的金属不完全相同;
C.pH相同的盐酸和醋酸,醋酸的浓度大于盐酸;
D.v(NO2)逆=2v(N2O4)正,说明正逆反应速率相等.
解答 解:A.在温度、压强一定的条件下,化学反应方向的判据为△H-T△S.如果△H-T△S<0,反应能自发进行;如果△H-T△S=0,反应达到平衡状态;如果△H-T△S>0,反应不能自发进行.反应2CO(g)=2C(s)+O2(g)△H>0,△S<0,所以△H-T△S>0,不能自发进行,催化剂对△H无影响,故A错误;
B.电解过程中,阳极上不仅有铜还有其它金属失电子,阴极上只有铜离子得电子,所以阳极减少的质量不等于阴极增加的质量,故B错误;
C.体积均为10mL pH均为2的盐酸与醋酸,溶液中氢离子浓度为0.001mol,0.1g Zn的物质的量为0.0015mol,Zn过量,醋酸能继续电离氢离子,所以醋酸中生成的氢气多,故C正确;
D.一定条件下反应2NO2(g)?N2O4(g)达到平衡时,v(NO2)逆=2v(N2O4)正,说明正逆反应速率相等,即该反应达到平衡状态,故D正确.
故选CD.
点评 本题考查了反应自发性的判断、电解原理的应用、弱电解质的电离、化学平衡状态的判断,题目难度不大,侧重于基础知识的考查,注意相关知识的积累,题目有利于培养学生对基础知识的综合应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列说法正确的是( )
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视刻度线,会使所配溶液浓度偏高 | |
| C. | 二氧化硅不与强酸反应,可用石英作为反应容器制取氢氟酸 | |
| D. | 燃着的镁条伸入盛满二氧化碳的集气瓶中,不能继续燃烧 |
15.A、B、C、D四种原子序数依次增大的元素,分布在三个不同的短周期,其中B与C为同一周期的相邻元素,A与D为同一主族.C原子的最外层电子数是次外层电子数的3倍,D是所在周期原子半径最大的元素.下列说法正确的是( )
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |
12.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,X的最外层电子数是次外层电子数的3倍,由此可知( )
| W | X | |
| Y | Z |
| A. | 离子半径:Z>Y>X>W | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z的气态氢化物中,Z的熔点最高 | |
| D. | X元素的一种氢化物含极性键和非极性键 |
19.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | 简单离子半径:W>Z>Y | |
| B. | X与W能形成共价化合物 | |
| C. | Y与Z组成的化合物溶于水呈酸性 | |
| D. | 元素X、Y、W的最高化合价均与其族序数相等 |
9.在Na2CO3溶液中,有关离子浓度的关系正确的是( )
| A. | c(Na+)=2c(CO32-) | B. | c(H+)>c(OH-) | C. | c(CO32-)>c(HCO3-) | D. | c(CO32-)>c(OH-) |
16.芳樟醇常用于合成香精,香叶醇存在于香茅油、香叶油、香草油、玫瑰油等物质中,有玫瑰花和橙花香气.它们的结构简式如下: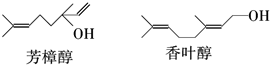
已知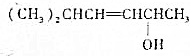 的键线式结构为
的键线式结构为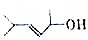 下列说法不正确的是( )
下列说法不正确的是( )

已知
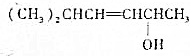 的键线式结构为
的键线式结构为 下列说法不正确的是( )
下列说法不正确的是( )| A. | 两种醇都能与溴水反应 | |
| B. | 两种醇互为同分异构体 | |
| C. | 两种醇与氧气在铜催化的条件下,均可被氧化为相应的醛 | |
| D. | 两种醇在浓H2S04存在下加热,均可与乙酸发生酯化反应 |
13.下列有关实验原理或操作叙述正确的是( )
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到表面皿上的pH试纸上测pH | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 取金属钠时,要先用镊子夹取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| D. | 用NaOH标准溶液滴定盐酸,滴定管尖嘴部分若在滴定前无气泡,滴定终点时出现气泡,测定结果将偏大 |
 2,3,3=三甲基戊烷 (6)
2,3,3=三甲基戊烷 (6) 3,3,4-三甲基己烷.
3,3,4-三甲基己烷.