题目内容
3.室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量.请分析上述实验过程中,①所发生的反应;②溶液的成分;③溶液的PH变化.并回答下列问题:(1)该反应的离子方程式为NH3•H2O+H+═NH4++H2O
(2)在实验过程中水的电离程度变化趋势是先大后小(选填“大”“小”或“不变”)
(3)在实验过程中,当溶液的PH恰好等于7时,溶液中对应溶质的化学式是NH4Cl和NH3•H2O.
此时溶液中离子浓度的大小顺序是c(Cl-)=c(NH4+)>c(H+)=c(OH-).
分析 (1)根据盐酸与氨水反应生成氯化铵和水书写离子方程式;
(2)酸溶液和碱溶液都抑制了水的电离,两溶液恰好反应时铵根离子发生水解,促进了水的电离,据此进行判断;
(3)在实验过程中,当溶液的pH恰好等于7时,则氨水应过量,则根据电荷守恒判断离子浓度大小关系.
解答 解:(1)盐酸与氨水反应生成氯化铵和水,反应的离子方程式为:NH3•H2O+H+═NH4++H2O,
故答案为:NH3•H2O+H+═NH4++H2O;
(2)向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,随着盐酸的加入,溶液中氢氧根离子浓度逐渐减小,则水的电离程度逐渐增大;当两溶液恰好反应生成氯化铵时水的电离程度最大,当盐酸的过量后,溶液中氢离子浓度逐渐增大,水的电离程度有逐渐减小,所有水的电离程度先大后小,
故答案为:大;小;
(3)在实验过程中,当溶液的pH恰好等于7时,则氨水应过量,溶液中对应溶质的化学式是NH4Cl和NH3•H2O;
pH恰好等于7,则c(H+)=c(OH-),由电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+)可知c(Cl-)=c(NH4+),所以溶液中离子浓度的大小顺序为:c(Cl-)=c(NH4+)>c(H+)=c(OH-),
故答案为:NH4Cl和NH3•H2O;c(Cl-)=c(NH4+)>c(H+)=c(OH-).
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及离子浓度大小比较、酸碱混合的定性判断、离子方程式书写、水的电离及其影响等知识,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握判断离子浓度大小常用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
12.下列反应的离子方程式书写不正确的是( )
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 双氧水作脱氧剂,用于消除水中的氯气:Cl2+H2O2═2H++O2+2Cl- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
13.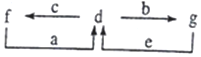 A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
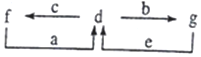 A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )| A. | 简单离子半径的大小:C>D>B | |
| B. | a中只含共价键,属于共价化合物 | |
| C. | 在水溶液中,b、g均呈酸性,c、f均呈碱性 | |
| D. | 工业上通过电解其氧化物的方法制取D的单质 |
10.下列化学用语的表示正确的是( )
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 1-丁烯的结构简式:CH3CHCHCH3 | |
| C. | HS-的水解方程式:HS-+H2O?S2-+H2O+ | |
| D. | 异丁烷的球棍模型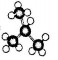 |
17. 某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
制备:在A中加入2~3片碎瓷片,8.0mL乙醇,4.0mL浓硫酸和5.7mL乙酸,连接好装置,在B中通入冷却水,用酒精灯缓慢加热A,回答下列问题:
(1)碎瓷片的作用是防止液体暴沸
(2)生成乙酸乙酯的化学方程式为CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
(3)加入药品前必须有的操作是检查装置的气密性;冷凝管中水流的方向是b进a出;温度最好控制在77.2℃.
(4)产品提纯过程;C中液体$→_{振动静置}^{饱和碳酸钠溶液}$$\stackrel{操作1}{→}$有机层,操作I名称是分液.
(5)本实验中,为提高乙酸的转化率采取的措施有使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量比例等(能回答出两条措施即可)(至少两点).
 某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.制备:在A中加入2~3片碎瓷片,8.0mL乙醇,4.0mL浓硫酸和5.7mL乙酸,连接好装置,在B中通入冷却水,用酒精灯缓慢加热A,回答下列问题:
(1)碎瓷片的作用是防止液体暴沸
(2)生成乙酸乙酯的化学方程式为CH3CH2OH+CH3COOH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.(3)加入药品前必须有的操作是检查装置的气密性;冷凝管中水流的方向是b进a出;温度最好控制在77.2℃.
(4)产品提纯过程;C中液体$→_{振动静置}^{饱和碳酸钠溶液}$$\stackrel{操作1}{→}$有机层,操作I名称是分液.
(5)本实验中,为提高乙酸的转化率采取的措施有使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量比例等(能回答出两条措施即可)(至少两点).
| 密度/(g•cm-3) | 沸点/℃ | |
| 乙酸 | 1.05 | 118.1 |
| 乙醇 | 0.780 | 78.3 |
| 乙酸乙酯 | 0.905 | 77.2 |
8.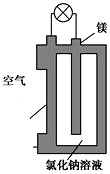 镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
 镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )| A. | 该电池的总反应为2Mg+O2═2MgO | |
| B. | 反应生成O2-,该离子有正极移向负极 | |
| C. | Cl-在阳极失去电子生成Cl2 | |
| D. | 正极反应式为O2+2H2O+4e-═4OH- |
15.短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol•L-1Q溶液是AG(酸度)=㏒$\frac{c({H}^{+})}{c(O{H}^{-})}$=-12,由M和Y组成的化合物MY是强电解质.下列说法正确的是( )
| A. | 简单离子半径:Y>R>X | |
| B. | Y的氧化物对应的水化物一定是强酸 | |
| C. | X分别与M、R、Y组成的二元化合物中都只含离子键 | |
| D. | 化合物XRM和XYR均能抑制水的电离 |
12.下列实验中,现象和对应结论均正确的是( )
| 选项 | 实 验 | 现 象 | 结 论 |
| A | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制 Cu(OH)2浊液,加热. | 没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| B | 分别向等浓度的Na2CO3溶液或 Na2SO4溶液中滴加酚酞试剂 | Na2CO3溶液变红色,Na2SO4溶液无明显现象 | 非金属性:S>C |
| C | 取无色溶液做焰色反应 | 焰色呈黄色 | 说明原溶液中一定不含钾元素 |
| D | 向品红溶液中滴加NaClO溶液或通入SO2气体 | 品红溶液均褪为无色 | 两者均有漂白性且原理相同 |
| A. | A | B. | B | C. | C | D. | D |
11.X、Y、Z是短周期元素的三种常见氧化物.X与水反应可生成一种具有还原性的不稳定的二元酸;Y与X的组成元素相同;1molZ在加热时与水反应的产物需要用6molNaOH才能完全中和;在一定条件下,Y可以与非金属单质A反应生成X和Z.下列说法不正确的是( )
| A. | X与水反应形成的二元酸的分子式是H2CO3 | |
| B. | Y是一种非极性分子,能与水反应生成强酸 | |
| C. | Y+A→X+Z的化学方程式为2 P+5SO3=5SO2+P2O5 | |
| D. | Z在加热时与水反应的产物名称是磷酸 |