题目内容
11.X、Y、Z是短周期元素的三种常见氧化物.X与水反应可生成一种具有还原性的不稳定的二元酸;Y与X的组成元素相同;1molZ在加热时与水反应的产物需要用6molNaOH才能完全中和;在一定条件下,Y可以与非金属单质A反应生成X和Z.下列说法不正确的是( )| A. | X与水反应形成的二元酸的分子式是H2CO3 | |
| B. | Y是一种非极性分子,能与水反应生成强酸 | |
| C. | Y+A→X+Z的化学方程式为2 P+5SO3=5SO2+P2O5 | |
| D. | Z在加热时与水反应的产物名称是磷酸 |
分析 从还原性二元酸入手推断,X跟水反应后可生成一种具有还原性的不稳定的二元酸应为H2SO3,X为SO2,Y与X的组成元素相同,应为SO3,Z反应生成酸要6mol一元碱中和,说明是2mol三元酸(没有符合条件的六元酸),Z应为P2O5,Y可以与非金属单质A反应生成X和Z,A为P,以此解答该题.
解答 解:由以上分析可知X为SO2、Y为SO3、Z为P2O5.
A.X为SO2,与水反应生成H2SO3,故A错误;
B.Y为SO3,分子中含有σ键,没有孤电子对,为sp2杂化,则为三角形分子,为非极性分子,可与水反应生成硫酸,故B正确;
C.A为P,与SO3反应生成二氧化硫和P2O5,反应的方程式为2 P+5SO3=5SO2+P2O5,故C正确;
D.Z为P2O5,加热时与水反应生成磷酸,故D正确.
故选A.
点评 本题为无机物的推断题,为高频考点,侧重考查学生的分析能力,题目主要考查P和S的化合物,做题时注意抓住物质的典型性质,本题难度不大,注意基础知识的积累.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
20.下列关于苯和甲苯的说法正确的是( )
| A. | 甲苯苯环上的一个氢原子被-C3H7取代得到的有机物结构共有3种 | |
| B. | 等质量的苯和甲苯分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同 | |
| C. | 苯和甲苯均能发生取代反应和加成反应 | |
| D. | 间二甲苯只有一种结构可说明苯分子中不存在碳碳单键与碳碳双键交替的结构 |
6. 正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
 正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电一段时间后右侧睡溶液pH升高 | |
| B. | 整个反应过程中,铜相当于催化剂 | |
| C. | 通空气时,铜被腐蚀,表面产生CuO | |
| D. | 放电时,正极的电极反应式为 Cu2O+H2O+2e-=Cu+2OH- |
16.不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9C1O的同分异构体中能与Na反应放出氢气的共有(不含立体异构)( )
| A. | 9 种 | B. | 10种 | C. | 11 种 | D. | 12 种 |
2.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A. | Y和Z可以组成元素质量比为7:16的化合物 | |
| B. | X和Y可以组成原子个数比分别为3:l和2:l的两种化合物 | |
| C. | 由X、Y、Z三种元素中任意两种组成的具有10电子的微粒多于2种 | |
| D. | X、Y、Z只能组成一种盐,其中X、Y、Z原子个数比为4:2:3 |
19. (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
请回答:
①表中3〜4min之间反应处于平衡状态;c3数值小于0.12mol/L(填大于、小于或等于).
②反应在4〜5min间,平衡向逆方向移动,可能的原因是b(单选),表中5〜6min之间数值发生变化,可能的原因是a(单选).
a.增加了水蒸气的量 b.升高温度 c.使用催化剂 d.增加压强
(3)如图是一个电化学的装置图.

①图中乙池是电解池装置(填“电解池”或“原电池”)甲池中OH-移向CH3OH极(填“CH3OH”或“O2”).若丙池中为400mL 1mol/L硫酸铜溶液,当外电路有1mol电子通过时,C、D两极共产生0.35mol的气体.
②写出B电极的电极反应式:Ag++e-=Ag.
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3〜4min之间反应处于平衡状态;c3数值小于0.12mol/L(填大于、小于或等于).
②反应在4〜5min间,平衡向逆方向移动,可能的原因是b(单选),表中5〜6min之间数值发生变化,可能的原因是a(单选).
a.增加了水蒸气的量 b.升高温度 c.使用催化剂 d.增加压强
(3)如图是一个电化学的装置图.

①图中乙池是电解池装置(填“电解池”或“原电池”)甲池中OH-移向CH3OH极(填“CH3OH”或“O2”).若丙池中为400mL 1mol/L硫酸铜溶液,当外电路有1mol电子通过时,C、D两极共产生0.35mol的气体.
②写出B电极的电极反应式:Ag++e-=Ag.
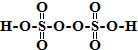 .其中O元素的化合价为-1、-2价.
.其中O元素的化合价为-1、-2价.