题目内容
15.短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol•L-1Q溶液是AG(酸度)=㏒$\frac{c({H}^{+})}{c(O{H}^{-})}$=-12,由M和Y组成的化合物MY是强电解质.下列说法正确的是( )| A. | 简单离子半径:Y>R>X | |
| B. | Y的氧化物对应的水化物一定是强酸 | |
| C. | X分别与M、R、Y组成的二元化合物中都只含离子键 | |
| D. | 化合物XRM和XYR均能抑制水的电离 |
分析 短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol•L-1Q溶液是AG(酸度)=㏒$\frac{c({H}^{+})}{c(O{H}^{-})}$=-12,中c(H+)=c(OH-)×10-12,结合水的离子积可知c(OH-)•c(OH-)×10-12=10-14,则c(OH-)=0.1mol/L,说明Q溶液为一元强电解质,则Q为NaOH,根据原子序数大小可知X为Na、R为O、M为H元素;由M和Y组成的化合物MY是强电解质,Y的原子序数大于Na,则Y为Cl元素,据此进行解答.
解答 解:短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol•L-1Q溶液是AG(酸度)=㏒$\frac{c({H}^{+})}{c(O{H}^{-})}$=-12,中c(H+)=c(OH-)×10-12,结合水的离子积可知c(OH-)•c(OH-)×10-12=10-14,则c(OH-)=0.1mol/L,说明Q溶液为一元强电解质,则Q为NaOH,根据原子序数大小可知X为Na、R为O、M为H元素;由M和Y组成的化合物MY是强电解质,Y的原子序数大于Na,则Y为Cl元素,
A.X为Na、R为O、Y为Cl元素,离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则简单离子半径:Y>R>X,故A正确;
B.Y为Cl元素,其最高价氧化对应水合物为强酸,没有指出最高价,则对应酸不一定为强酸,如次氯酸,故B错误;
C.X(Na)分别与M(H)、R(O)、Y(Cl)组成的二元化合物中,过氧化钠既含有离子键又含有共价键,故C错误;
D.化合物XRM为NaOH,XYR为NaClO,氢氧化钠抑制了水的电离,而次氯酸钠能够促进水的电离,故D错误;
故选A.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的综合应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 利用植物油的氧化反应可获得人造脂肪 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 工业生产玻璃、水泥和陶瓷,均需用石灰石作原料 | |
| D. | 明矾和“84”消毒液均可用于自来水的杀菌消毒 |
| 选项 | 实验操作和现象 | 结论 |
| A | 将Fe(NO3)2样品溶于稀H2SO4,溶液呈黄色. | Fe(NO3)2样品已被氧化变质 |
| B | 室温下,向  浊液中滴加Na2CO3溶液,浊液变澄清. 浊液中滴加Na2CO3溶液,浊液变澄清. | CO32-结合H+的能力比 的强 的强 |
| C | 向Na2SiO3溶液中滴加稀硫酸,出现白色胶状沉淀. | 非金属性:S>Si |
| D | 向BaSO4中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤.向滤渣中加盐酸,有气泡产生. | Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
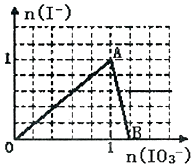 在含3molNaHSO3的溶液中加入含a mol NaIO3的溶液充分反应(不考虑I2+I-?I3-),所得溶液中的I-与加入NaIO3的物质的量的关系曲线如图所示,下列说法不正确的是( )
在含3molNaHSO3的溶液中加入含a mol NaIO3的溶液充分反应(不考虑I2+I-?I3-),所得溶液中的I-与加入NaIO3的物质的量的关系曲线如图所示,下列说法不正确的是( )| A. | 还原性HSO3->I-,氧化性:IO3->SO42->I2 | |
| B. | 当a=1时,溶液中n(I2):n(I-)=3:5 | |
| C. | AB段,反应的离子方程式为:IO3-+5I-+6H+═3I2+3H2O | |
| D. | l<a<1.2时,溶液中SO42-与I-的物质的量之比为3:(6-5a) |
| A. | 阳极附近溶液呈无色 | B. | 溶液的pH变大 | ||
| C. | 阳极逸出气体 | D. | 阴极附近溶液呈蓝色 |
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 用NaOH溶液滴定醋酸溶液,加入甲基橙作指示剂 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 将一定质量的AlCl3加入到容量瓶中加水定容,配制一定浓度的AlCl3溶液 |
| A. | Y和Z可以组成元素质量比为7:16的化合物 | |
| B. | X和Y可以组成原子个数比分别为3:l和2:l的两种化合物 | |
| C. | 由X、Y、Z三种元素中任意两种组成的具有10电子的微粒多于2种 | |
| D. | X、Y、Z只能组成一种盐,其中X、Y、Z原子个数比为4:2:3 |
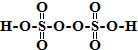 .其中O元素的化合价为-1、-2价.
.其中O元素的化合价为-1、-2价.