题目内容
6.硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)-炭粉还原法制备,原理为:Na2SO4+2CNa2?S+2CO2↑.其主要流程如图:
(1)上述流程中采用稀碱液比用热水更好,理由是热水会促进Na2S水解,而稀碱液能抑制Na2S水解.
(2)已知:I2+2S2O═2I-+S4O.所制得的Na2S•9H2O晶体中含有Na2S2O3•5H2O等杂质.为测定产品的成分,进行下列实验,步骤如下:
a.取试样10.00g配成500.00mL溶液.
b.取所配溶液25.00mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00mol•L-1 I2溶液滴定至终点,用去5.00mL I2溶液.
c.再取所配溶液25.00mL于碘量瓶中,加入50.00mL 0.050 00mol•L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡.用标准Na2S2O3溶液滴定多余的I2,用去15.00mL 0.100 0mol•L-1 Na2S2O3溶液.
①步骤b中用ZnCO3除去Na2S的离子方程式为ZnCO3+S2-═ZnS+CO.
②判断步骤c中滴定终点的方法为溶液由蓝色变为无色,且半分钟内不变色.
③计算试样中Na2S•9H2O和Na2S2O3•5H2O的质量分数,写出计算过程.
分析 (1)依据硫化钠溶液中硫离子水解显碱性的水解平衡影响因素分析判断;
(2)①ZnCO3与Na2S反应生成硫化锌和一氧化碳;
②滴定终点为溶液由蓝色变为无色,且半分钟内不变色;
③根据I2~2Na2S2O3•5H2O可得n(Na2S2O3•5H2O)=2n(I2),步骤b与c中样品用来相同,则可得到步骤c中Na2S2O3消耗的碘,再根据多余的碘结合I2~Na2S•9H2O可知Na2S的物质的量,再由质量分数=$\frac{物质的质量}{样品的质量}×100%计算$可得.
解答 解:(1)上述流程中采用稀碱液比用热水更好,硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用;
故答案为:热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(2)①ZnCO3除去Na2S的离子方程式为:ZnCO3+S2-═ZnS+CO,故答案为:ZnCO3+S2-═ZnS+CO;
②滴定终点为:溶液由蓝色变为无色,且半分钟内不变色,故答案为:溶液由蓝色变为无色,且半分钟内不变色;
③步骤b中消耗的I2有:
n(I2)=0.050 00 mol•L-1×5.00 mL×10-3 L•mL-1=2.500×10-4 mol
n(Na2S2O3•5H2O)=2n(I2)=5.000×10-4 mol
w(Na2S2O3•5H2O)=$\frac{5×1{0}^{-4}mol×248g/mol}{0.5g}$×100%=24.8%
步骤c中,加入的I2有:
n(I2)=0.050 00 mol•L-1×50.00 mL×10-3 L•mL-1=2.500×10-3 mol
由步骤b可知25mL溶液中Na2S2O3消耗的I2有:2.500×10-4 mol
滴入的标准Na2S2O3溶液消耗多余的I2有:15.00 mL×10-3 L•mL-1×0.100 0 mol•L-1×=7.500×10-4 mol
溶液中Na2S有:
n(Na2S•9H2O)=n(Na2S)=(2.500×10-3-2.500×10-4-7.500×10-4)mol=1.500×10-3 mol
w(Na2S•9H2O)=$\frac{1.5×1{0}^{-3}mol×240g/mol}{0.5g}$×100%=72.0%
答:试样中Na2S•9H2O的质量分数为72%,Na2S2O3•5H2O的质量分数为24.8%.
点评 本题是物质制备的考查题,主要是温度对水解平衡的影响,化学方程式书写方法,氧化还原反应滴定的计算应用,掌握基础是关键,题目难度中等.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案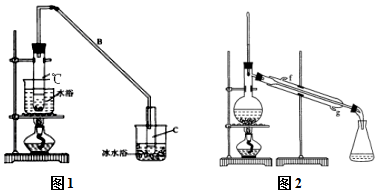 某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯已知:
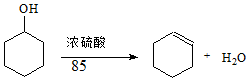
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
①A中碎瓷片的作用是防暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯挥发或冷凝环己烯.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填上或下),分液后,用CD(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从g(填f或g)口进入,蒸馏时要加入生石灰,目的是除水.
③收集产品时,控制的温度应在83℃ 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是BC.
A.酸性KMnO4溶液 B.用金属钠 C.测定沸点 D.溴的四氯化碳溶液.
| A. | 通入过量的NH3(g):Ag+、NH4+、NO3-、OH- | |
| B. | 加入过量 HNO3(aq):NH4+、Ag+、H+、NO3- | |
| C. | 通入过量 HCl(g):NH4+、H+、Cl-、NO3- | |
| D. | 加入过量NaOH(aq):NH4+、Na+、NO3-、OH- |
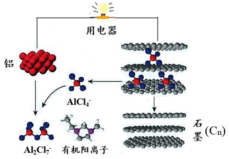 近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时,A1Cl4-向石墨电极移动 | |
| C. | 放电时,负极的电极反应式为A1十7A1Cl4--3e-=4 A12Cl7- | |
| D. | 充电时,电子从石墨电极直接经导线流入铝电极,然后再经电解质溶液流回石墨电极 |
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成2 mol AlN需转移6 mol电子 | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | AlN的摩尔质量为41 g |
| 选项 | 性质 | 应用 |
| A | Na2O2与水、CO2反应 | 潜水艇O2的来源 |
| B | 单质镁有强还原性 | 镁合金作飞机材料 |
| C | 次氯酸及其盐具有漂白性 | 净化饮用水 |
| D | 铜不与O2反应 | 制备铜币 |
| A. | A | B. | B | C. | C | D. | D |
 ),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )
),同时利用此装置的电能在铁上镀铜,下列说法正确的是( )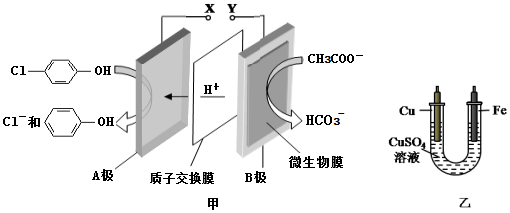
| A. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1 NA | |
| B. | A极的电极反应式为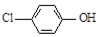 +e-=Cl-+ +e-=Cl-+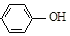 | |
| C. | 铁电极应与Y相连接 | |
| D. | 反应过程中甲中右边区域溶液pH逐渐升高 |
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O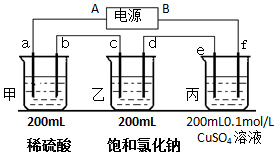 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则