题目内容
2.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
分析 A.H2CO3存在两步电离,第一步电离对第二步电离起到抑制作用;Na2CO3在溶液中完全电离出CO32-;NaHCO3在溶液中完全电离出HCO3-;(NH4)2CO3在溶液中完全电离出CO32-和NH4+,铵根离子和碳酸根离子发生相互促进的水解反应;
B.根据溶液中的电荷守恒分析;
C.向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液,混合后溶液中溶质为NaHCO3、Na2CO3,CO32-的水解程度大于HCO3-的水解程度;
D.常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7,则CH3COOH的电离程度大于CH3COONa的水解程度.
解答 解:A.H2CO3存在两步电离,第一步电离对第二步电离起到抑制作用;Na2CO3在溶液中完全电离出CO32-;NaHCO3在溶液中完全电离出HCO3-;(NH4)2CO3在溶液中完全电离出CO32-和NH4+,铵根离子和碳酸根离子发生相互促进的水解反应,则Na2CO3溶液中c(CO32-)大于(NH4)2CO3溶液中c(CO32-)所以c(CO32-)的大小关系为:②>④>③>①,故A正确;
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合,混合溶液中溶质为H2C2O4、NaHC2O4、溶液中的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故B错误;
C.向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液,混合后溶液中溶质为NaHCO3、Na2CO3,CO32-的水解程度大于HCO3-的水解程度,所以c(HCO3-)>c(CO32-),溶液显碱性,则c(OH-)>c(H+),所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7,则CH3COOH的电离程度大于CH3COONa的水解程度,则c(CH3COO-)>c(CH3COOH),溶液中电荷守恒为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COOH)+c(OH-)<c(Na+)+c(H+),故D错误.
故选A.
点评 本题考查了弱电解质的电离、盐的水解、离子浓度大小比较、电离平衡移动等知识点,根据溶液中的溶质及其性质确定溶液中离子浓度大小,再结合外界条件对化学平衡的影响来确定溶液中离子浓度变化,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

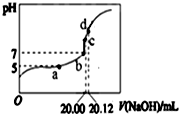 常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | a点所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | d点所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| A. | 离子半径:丁>丙>乙 | |
| B. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| C. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 | |
| D. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 |
| A. | Si | B. | P | C. | S | D. | Cl |
①Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3
②S$\stackrel{O_{2}/点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO3
③Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3$\stackrel{△}{→}$无水FeCl3
下列判断正确的是( )
| A. | 步骤①②中的SO2气体和CO2气体可以用澄清石灰水溶液鉴别 | |
| B. | 步骤③中,检验FeCl3(aq)溶液中是否存有Fe2+,应该选用KSCN溶液 | |
| C. | 三个步骤中都没有氧化还原反应 | |
| D. | 常温下,H2SO3溶液中通入少量氯气,溶液pH减小,Kw不变 |
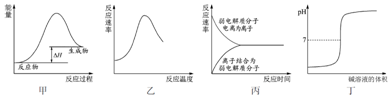
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |
| A. | 氯化铵与消石灰反应 | B. | 酸碱中和反应 | ||
| C. | 铝热反应 | D. | 锌与盐酸反应 |
