题目内容
17.核潜艇上的核反应堆内使用了液体铝合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )| A. | 离子半径:Na+>Al3+ | |
| B. | 铝钠合金若投入一定水中可得无色溶液并产生气泡 | |
| C. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
分析 A.核外电子数相同的,原子序数越大,半径越小;
B.铝钠合金若投入一定的水中可得无色溶液,说明钠和水反应生成的氢氧化钠足以将金属铝溶解;
C.等质量的金属钠和金属铝,金属Al产生的氢气量多,铝钠合金与盐酸反应放出的H2越多,铝的质量分数越大;
D.钠和水反应生成氢氧化钠和氢气,铝和氢氧化钠反应,氯化铜和氢氧化钠反应生成氢氧化铜沉淀,铝过量能置换出铜.
解答 解:A.核外电子数相同的,原子序数越大,半径越小,Na+>Al3+,故A正确;
B.铝钠合金若投入一定的水中发生2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,只有当n(Al)≤n(Na)时,得到无色溶液,故B错误;
C.根据金属钠和金属铝和酸反应生成氢气量的关系:2Al~3H2↑,2Na~H2↑,等质量的金属钠和金属铝,则金属Al产生的氢气量多,所以放出的H2越多,则铝的质量分数越大,故C错误;
D.铝钠合金投入到足量氯化铜溶液中,钠和水反应2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠可以和氯化铜反应生成氢氧化铜沉淀,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若n(Al)>n(Na),金属铝也可能会置换出氯化铜中的金属铜,故D正确.
故选BC.
点评 本题综合考查钠、铝的性质,注意根据2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑方程式进行判断是解答关键,题目难度中等.

练习册系列答案
相关题目
8.将一定量的CO2溶于100mL的0.4mol•L-1 KOH溶液.CO2被完全吸收,得到K2CO3和KHCO3的混合溶液.向所得溶液中逐滴加入0.2mol•L-1盐酸,至逸出的CO2与原先吸收的CO2质量相等.此时消耗的盐酸的体积为( )
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
5.硫酸锰可用于饲料营养强氧化剂和媒染剂.其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺如图1:
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )
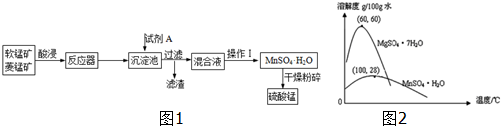
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )

| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1molH2O含有的H2O分子数为NA | |
| B. | 1mol金属镁与足量的盐酸完全反应,转移的电子数为2NA | |
| C. | 11.2L氧气含有的O2分子数为0.5NA | |
| D. | 将含1molFeCl3的溶液与沸水完全反应,生成的Fe(OH)3胶体粒子数为NA |
7.硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”.这主要是由于硅及其化合物对社会发展所起的巨大促进作用.下列关于硅及其化合物的说法中错误的是( )
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |

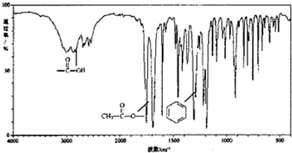 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: .
.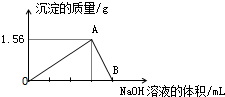 向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题: