题目内容
11.一定条件下,发生反应:X(g)+3Y(g)?2Z(g),不能说明反应达到化学平衡的是( )| A. | Z的分解速率和生成速率相等 | |
| B. | X、Y、Z的浓度不再变化 | |
| C. | 反应体系的总质量保持不变 | |
| D. | 单位时间内生成2nmolZ,同时生成nmolX |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.Z的分解速率和生成速率相等,其正逆反应速率相等,反应达到平衡状态,故A不选;
B.X、Y、Z的浓度不再变化,正逆反应速率相等,反应达到平衡状态,故B不选;
C.任何化学反应都遵循质量守恒,无论反应是否达到平衡状态都存在质量守恒,所以不能根据反应体系的总质量判断平衡状态,故C选;
D.单位时间内生成2nmolZ,同时生成nmolX、同时消耗2nmolZ,正逆反应速率相等,反应达到平衡状态,故D不选;
故选C.
点评 本题考查化学平衡状态判断,为高频考点,侧重考查学生分析判断能力,只有反应前后改变的物理量不变时可逆反应达到平衡状态,难点是选取反应前后改变的物理量,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
1.下列说法啊正确的为( )
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③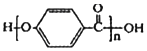 的结构中含有酯基
的结构中含有酯基
④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物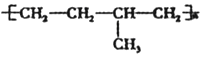 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得
⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
①植物油和裂化汽油都可以使溴水褪色
②煤经过气化、液化等物理变化可以得到清洁燃料
③
 的结构中含有酯基
的结构中含有酯基④1摩尔葡萄糖可以水解生成2摩尔乳酸(C3H6O3)
⑤聚合物
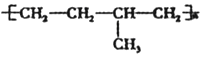 可由单体CH3-CH=CH2 和CH2=CH2加聚制得
可由单体CH3-CH=CH2 和CH2=CH2加聚制得⑥煤含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯.
| A. | ①③⑤ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③④ |
19.分类是学习化学常用的方法,下列关于物质的分类说法正确的是( )
| A. | CO2、SO2、CO都是酸性氧化物 | B. | Na2O、Al2O3、CuO都是碱性氧化物 | ||
| C. | HCl、HClO、HClO4都是强酸 | D. | CH3COOH、HNO3、HSCN都是一元酸 |
16.某温度下,测得纯水中的c(H+)=2×10-7 mol/L,则c(OH-)为( )
| A. | 2×10-7 mol/L | B. | 0.1×10-7 mol/L | C. | 0.5×10-7 mol/L | D. | 无法确定 |
3.在加热时,浓硫酸与铜发生反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.对于该反应,下列说法不正确的是( )
| A. | 是氧化还原反应 | B. | 铜是还原剂 | ||
| C. | 部分H2SO4被还原 | D. | Cu发生了还原反应 |

 .
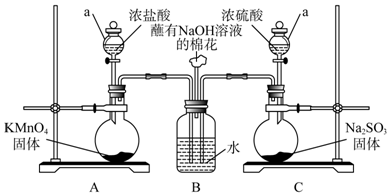
.
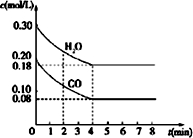 (1)已知在一定温度下,各反应的平衡常数如下:
(1)已知在一定温度下,各反应的平衡常数如下: